
已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O 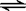 CH3COO—+H3O+
K1=1.75×10-5
CH3COO—+H3O+
K1=1.75×10-5
CH3COO—+H2O 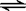 CH3COOH+OH—
K2=5.71×10-10
CH3COOH+OH—
K2=5.71×10-10
现有50 mL 0.2 mol·L-1醋酸与50 mL 0.2 mol·L-1醋酸钠混合制得溶液甲,下列叙述正确的是
A.甲溶液的pH >7
B.对甲进行微热,K1、K2同时增大
C.若在甲中加入很少量的NaOH溶液,溶液的pH几乎不变
D.若在甲中加入5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的K1会变大
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①④ | B、①②④ | C、①②④⑤ | D、①②③④ |
查看答案和解析>>
科目:高中化学 来源:模拟题 题型:单选题
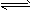 CH3COO-+H3O+ K1=1.75×10-5
CH3COO-+H3O+ K1=1.75×10-5 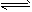 CH3COOH+OH- K2 =5.71×10-10
CH3COOH+OH- K2 =5.71×10-10 查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com