
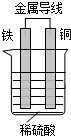
 (1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:
(1)某实验小组为了探究影响化学反应速率的因素,进行了稀硫酸与金属铁反应的对照实验,实验数据如下:| 实验序号 | 金属质量 /g | 金属状态 | c(H2SO4) /mol•L-1 | V(H2SO4) /mL | 反应前溶液温度/℃ | 金属消失的时间/s |
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 50 |
| 3 | 0.10 | 丝 | 1.0 | 50 | 20 | 125 |
| 4 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 |
分析 (1)实验1和3中只有硫酸的浓度不同,其它反应条件完全相同,目的是探究浓度对反应速率的影响;实验1和2中只有铁的形态不同,其它反应条件完全相同,目的是探究固体表面积对反应速率的影响;
(2)铁铜稀硫酸构成原电池,能将化学能转化为电能,活泼金属铁作负极;
(3)普通干电池,手机充电电池,铅蓄电池都是生活中常见的电池.
解答 解:(1)实验1和3中只有硫酸的浓度不同,其它反应条件完全相同,目的是探究浓度对反应速率的影响,浓度大的反应更快,金属消失的时间更短;实验1和2中只有铁的形态不同,其它反应条件完全相同,固体表面积大的(粉末壮),金属消失的时间更短,反应速度更快,故答案为:浓度的大小;固体表面积;
(2)铁铜稀硫酸构成原电池,能将化学能转化为电能,活泼金属铁作负极,故答案为:电;负极;
(3)普通干电池,手机充电电池,铅蓄电池都是生活中常见的电池,故答案为:普通干电池,手机充电电池,铅蓄电池.
点评 本题考查探究影响化学反应速率的因素以及原电池的工作原理,题目难度中等,明确温度、固体表面积、浓度对反应速率的影响是解本题的关键.


科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 李比希燃烧法、钠熔法、铜丝燃烧法都是用来分析有机物元素组成的方法 | |
| B. | 红外光谱法、紫外光谱法、核磁共振、质谱仪等都是现代化学测定有机物结构的常用方法 | |
| C. | 同位素示踪法是研究化学反应历程的手段之一 | |
| D. | CH3COOCH2CH3与CH3CH2COOCH3互为同分异构体,1H-NMR 谱显示两者均有三种不同的氢原子且三种氢原子的比例相同,故不能用1H-NMR 来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 依据“溶液中的离子平衡”相关化学知识,回答下列问题.
依据“溶液中的离子平衡”相关化学知识,回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢镁与氢氧化钠反应:Mg2++2HCO3-+2OH-═MgCO3↓+2H2O | |
| B. | 溴化亚铁溶液中通入过量的氯气:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- | |
| C. | 碳酸钙中滴入醋酸:CaCO3+2CH3COOH=2CH3COO-+Ca2++CO2↑+H2O | |
| D. | 偏铝酸钠溶液中通入过量的CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:1 | B. | 6:1 | C. | 3:1 | D. | 1:6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com