

 | V(0.5mol•L-1 HCl)/mL | m(CaCO3)/g | CaCO3状态 | V(蒸馏水)/mL | 实验目的 | |
| 实验1 | 40.0 | 0.8 | ①实验1和2探究固体表面积对反应速率的影响; ②实验1和3探究反应物浓度对反应速率的影响 | |||
| 实验2 | 40.0 | 0.8 | ||||
| 实验3 | 60.0 | 0.8 |
分析 (1)测定CaCO3固体与过量0.1mol•L-1 HCl的反应速率,可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率;
(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率;
②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验;
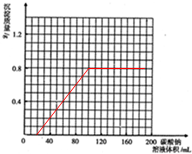
(3)根据计算所得数据在图丁中画出产生沉淀的曲线.
解答 解:(1)可以根据单位时间内二氧化碳的生成量或单位时间内碳酸钙的消耗量判断反应速率,即测定生成二氧化碳的体积(或质量)和反应时间,或测定消耗碳酸钙固体的质量和反应时间,
故答案为:生成二氧化碳的体积(或质量);反应时间;消耗碳酸钙固体的质量;反应时间;
(2)①在固体表面积或反应物浓度不同的条件下,通过测定单位时间内二氧化碳的生成速率判断反应速率,故答案为:生成等质量CO2所需的时间(或相同时间内生成的CO2的质量);
②据盐酸浓度相同时,块状碳酸钙与粉末状碳酸钙生成二氧化碳的速率和碳酸钙状态相同盐酸浓度不同时生成二氧化碳速率进行实验,
| 物理量 实验序号 | V(0.5mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 t/s |
| 实验1 | 40 | 0.8 | 60 | d | ||
| 实验2 | 40 | 0.8 | 60 | d | ||
| 实验3 | 60 | 0.8 | 40 | d |
| 物理量 实验序号 | V(0.5mol/L的HCl)/mL | m(块状碳酸钙质量)/g | m(粉末状碳酸钙质量)/g | V(蒸馏水)/mL | m(二氧化碳)/g | 反应时间 t/s |
| 实验1 | 40 | 0.8 | 60 | d | ||
| 实验2 | 40 | 0.8 | 60 | d | ||
| 实验3 | 40 | 0.8 | 40 | d |
 ,
, .
.点评 本题考查了化学反应速率的求算以及化学反应速率的实验测定,题目难度较大.


 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:选择题
| A. | X>2 | B. | X=2 | C. | 2>X>1 | D. | X=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓氨水 | B. | NaOH | C. | Ba(OH)2 | D. | Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
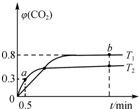 利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )
利用I2O5可消除CO污染,反应为5CO(g)+I2O5(s)?5CO2(g)+I2(s);△H.不同温度(T1、T2)下,向装有足量I2O5固体的2L恒容密闭容器中通入2mol CO,测得CO2气体体积分数φ(CO2)随时间t变化曲线如图所示.下列说法正确的是( )| A. | T1<T2,△H>0 | |
| B. | T1温度下,该反应的平衡常数为1 024 | |
| C. | T2温度下,0~0.5 min内,CO的平均反应速率为0.3 mol•L-1•min-1 | |
| D. | T1温度下,若向装有足量I2固体的2 L恒容密闭容器中通入10 mol CO2,达到平衡时,φ(CO2)=0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 单质能与水剧烈反应,所得溶液呈弱酸性 |
| X | 原子最外层电子数是次外层的3倍 |
| Y | 第三周期元素的简单离子中半径最小 |
| Z | 气态氢化物与最高氧化物对应水化物可发生化合反应 |
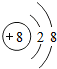 .写出元素Z的单质的电子式
.写出元素Z的单质的电子式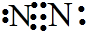 (用元素符号表示)
(用元素符号表示)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com