
分析 发生反应:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,利用差量法计算参加反应Cu的质量、生成NO的体积、消耗硝酸物质的量,进而计算反应后溶液中H+的物质的量浓度.
解答 解:设反应Cu的质量为m,消耗硝酸物质的量为n,生成NO的体积为V,则:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O 溶液质量增重
192g 8mol 44.8L 192g-60g=132g
m n V 2.64g
(1)则V=$\frac{44.8L×2.64g}{132g}$=0.896L=896mL,故答案为:896;
(2)则m=$\frac{2.64g×192g}{132g}$=3.84g,故答案为:3.84;
(3)则n=$\frac{8mol×2.64g}{132g}$=0.16mol,故反应后溶液中H+的物质的量浓度为 3mol/L-$\frac{0.16mol}{0.1L}$=1.4mol/L,故答案为:1.4mol/L.
点评 本题考查化学方程式计算,难度不大,注意利用差量法计算,注意方程式计算中若左右单位不同时,应上下单位相同、左右相当.


科目:高中化学 来源: 题型:解答题
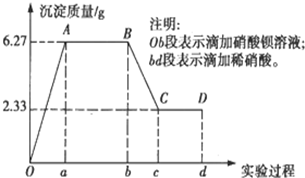 某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示:
某化学研究性学习小组对某无色水样的成分进行检验,已知该水样中只可能含有K+、Mg2+、Fe3+、Cu2+、Al3+、Ag+、Ca2+、CO32-、SO42-、Cl-中的若干种离子.该小组同学取100mL水样进行实验,向水样中先滴加硝酸钡溶液,再滴加2mol/L的硝酸,实验过程中沉淀质量的变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 食醋中乙酸含量为3~5g/100mL | B. | 与HCOOCH3互为同分异构体 | ||
| C. | 可用分液法分离乙酸和水 | D. | 能与碳酸钠溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出)
在如图所示的物质转化关系中,A是海水中含量最丰富的盐,B是常见的无色液体,G的水溶液是一种常用的漂白剂.(反应中生成的水和部分反应条件未列出) .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 利用I2O5可消除CO污染或定量测定CO,反应为:
利用I2O5可消除CO污染或定量测定CO,反应为:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com