
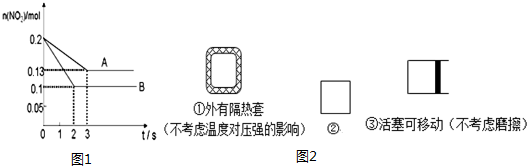
分析 (1)由图象可知B状态反应较快,且A、B处于不同平衡状态,B状态NO2的物质的量较少,结合温度、压强对平衡移动的影响判断;
(2)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积计算,结合温度对平衡移动的影响判断;
(3)根据NO2的物质的量结合方程式可判断平衡时O2的浓度,进而可计算O2的反应速率;
(4)2NO+O2?2NO2由(1)的推断可知该反应为放热反应,根据温度压强对平衡的影响分析;
(5)该反应是一个反应前后气体体积减小、放热的可逆反应,相同温度下,压强越大越有利于平衡向正反应方向移动.
解答 解:(1)由图象可知B状态反应较快,且A、B处于不同平衡状态,肯定不是催化剂的影响,如是压强的影响,则增大压强,平衡向逆反应方向移动,则NO2的物质的量应增大,但B状态NO2的物质的量较少,应是升高温度的原因,该反应的正反应为吸热反应,升高温度平衡向正反应方向移动,则NO2的物质的量减少,故答案为:B;
(2)平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,则k=$\frac{{c}^{2}(NO)c({O}_{2})}{{c}^{2}(N{O}_{2})}$,反应的正反应为吸热反应,升高温度平衡向正反应方向移动,则平衡常数增大,
故答案为:k=$\frac{{c}^{2}(NO)c({O}_{2})}{{c}^{2}(N{O}_{2})}$;<;
(3)根据图象可知,B状态时,平衡时NO2的物质的量为0.1mol,则反应的NO2的物质的量为0.1mol,生成O2的物质的量为0.05mol,则VO2=$\frac{\frac{0.05mol}{VL}}{2s}$=$\frac{0.025}{V}$mol/(L•s),
故答案为:$\frac{0.025}{V}$mol/(L•s);
(4)2NO+O2?2NO2由(1)的推断可知该反应为放热反应,容器①外面有隔热套,反应放热则容器内温度升高,平衡逆移,NO物质的百分含量增大;容器③有自由移动的活塞,容器内为恒压状态,而容器②体积不变反应后气体物质的量减少,压强减小,所以容器③的压强大于容器②的压强,所以容器③内向正方向进行的程度大,NO物质的百分含量减小,所以NO物质的百分含量由大到小的顺序为①②③,故答案为:①②③;
(5)若温度不变,反应过程②中的压强不断减小,③的压强始终不变,导致反应过程中丙的压强始终比乙大,有利于③向正反应方向移动,所以达到平衡时,两容器中NO的转化率②<③,故答案为:<.
点评 本题考查较为综合,涉及化学平衡的计算,外界条件对平衡移动的影响以及平衡状态的判断,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 1.2mol•(L•min) -1 | B. | 18mol•(L•min)-1 | C. | 0.6mol•(L•min) -1 | D. | 0.4mol•(L•min)-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某研究性学习小组进行原电池和电解的实验.
某研究性学习小组进行原电池和电解的实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金刚烷( )分子中含有4个 )分子中含有4个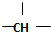 | |
| B. | 利用核磁共振氢谱可以鉴别乙醇和二甲醚 | |
| C. | 高聚物的相对分子质量不一定为单体相对分子质量的整数倍 | |
| D. | 苯、甲苯、乙苯、三硝基甲苯等都是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素位于周期表的第二周期0族 | |
| B. | 该元素最高价氧化物对应水化物为强碱 | |
| C. | 该元素第一电离能为本周期最小 | |
| D. | 该元素电负性为短周期最小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔鉴别淀粉溶液与氯化钠溶液 | |
| B. | 用KOH溶液鉴别NH4Cl、AlCl3、MgSO4、FeCl3四种溶液 | |
| C. | 用盐酸溶液鉴别Na2CO3溶液和Na2SiO3溶液 | |
| D. | 用BaCl2溶液鉴别AgNO3和Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H8 和 C3H6 | B. | C2H6 和 C3H6 | C. | C2H4 和 C4H8 | D. | CH4 和 C2H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
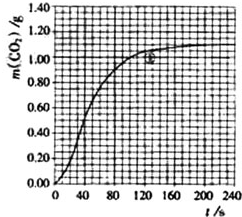 某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.
某探究小组用HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素.所用HNO3浓度为1.00mol•L-1、2.00mol•L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298K、308K,每次实验HNO3的用量为25.0mL、大理石用量为10.00g.| 实验编号 | T/K | 大理石规格 | HNO3浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和③探究温度对该反应速率的影响; (Ⅲ)实验①和④探 究大理石规格(粗、细)对该反 应速率的影响;) |
| ② | ||||
| ③ | ||||
| ④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com