
| A. | CO2和NaOH溶液 | B. | SO2和稀氨水 | C. | NO2和NaOH溶液 | D. | Cl2和饱和食盐水 |
分析 喷泉实验的形成原理是气体极易溶于水(或溶液)或与水(或溶液)发生反应而导致容器压强减小,形成负压差,从而形成喷泉,据此分析解答.
解答 解:A.二氧化碳与氢氧化钠反应,被氢氧化钠吸收,形成负压差,可以产生喷泉实验,故A不选;
B.二氧化硫为酸性氧化物,能够与稀氨水反应,被稀氨水吸收,形成负压差,可以产生喷泉实验,故B不选;
C.二氧化氮与氢氧化钠溶液反应,被氢氧化钠溶液吸收,形成负压差,可以产生喷泉实验,故C不选;
D.氯气与饱和氯化钠溶液不反应,且在饱和氯化钠溶液中溶解度不大,不能形成负压差,不会产生喷泉实验,故D选;
故选D.
点评 本题考查了喷泉实验,明确喷泉实验的原理和常见气体的性质是解题关键,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
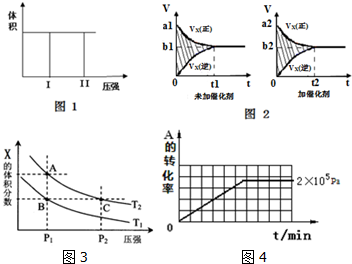
| 压强p/Pa | 2×105 | 5×105 | 1×106 |
| c(A)/mol•L-1 | 0.08 | 0.20 | 0.44 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 需加入的除杂试剂 | 发生反应的离子方程式 | |
| ①CO2气体中混有HCl杂质 | 饱和NaHCO3溶液 | H++HCO3-=H2O+CO2↑ |
| ②NaHCO3溶液中混有Na2CO3 | 足量CO2 | CO32-+H2O+CO2=HCO3- |
| ③FeCl2溶液中混有FeCl3杂质 | 铁粉 | Fe+2Fe3+=3Fe2+ |
| ④Fe2O3固体中混有Al2O3杂质 | NaOH溶液 | Al2O3+2OH-=AlO2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一氧化碳的转化率提高,水蒸气的转化率降低 | |
| B. | 反应物的转化率都提高 | |
| C. | 平衡向正反应方向移动,达到新的平衡时二氧化碳的体积分数增大 | |
| D. | 平衡向正反应方向移动,二氧化碳的物质的量将大于1 mol但小于2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸 | 电离常数 |
| CH3COOH | K=1.75×10-5 |
| H2CO3 | K1=4.4×10-7 k2=4.7×10-11 |
| HClO | K=3.2×10-8 |
| A. | ②>④>③>① | B. | ①>③>④>② | C. | ③>②>④>① | D. | ③>④>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com