
| A. | 化合反应 | B. | 分解反应 | C. | 复分解反应 | D. | 置换反应 |
分析 有化合价变化的反应是氧化还原反应.
解答 解:A、氧化钠和水反应生成氢氧化钠的过程属于化学反应,但是没有元素的化合价变化,则不属于氧化还原反应,一般有单质参加的化合反应,存在元素的化合价变化,则属于氧化还原反应,故A错误;
B、没有单质生成的分解反应,没有元素的化合价变化,则不属于氧化还原反应,但有单质生成的分解反应,存在元素的化合价变化,则属于氧化还原反应,故B错误;
C、复分解反应中一定没有元素的化合价变化,则一定不属于氧化还原反应,故C错误;
D、置换反应中一定存在元素的化合价变化,则一定属于氧化还原反应,故D正确.
故选D.
点评 本题考查学生氧化还原反应和四大基本反应类型之间的关系知识,可以根据所学知识进行回答,较简单.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤ | B. | ①③④ | C. | ①②③④ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
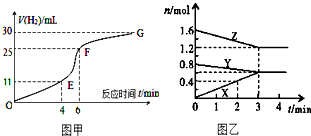 化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:
化学反应速率和限度是中学化学原理中很重要部分,根据所学知识回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶的标签,试根据标签上的有关数据回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com