
| 1173K |
| 1220K~1420K |
| A、反应Ⅰ中的TiO2是氧化剂 |
| B、TiCl4在反应Ⅰ中是还原产物,在反应Ⅱ中是氧化剂 |
| C、a=b=c=2 |
| D、每生成9.6 g Ti,反应Ⅰ、Ⅱ中共转移0.8 mol电子 |
| 1173K |
| 1220K~1420K |


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
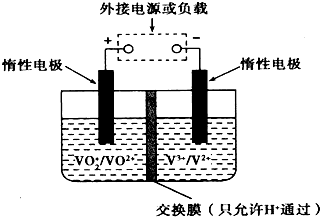 钒(V)及其化合物广泛应用于工业催化,新材料和心能源等领域.
钒(V)及其化合物广泛应用于工业催化,新材料和心能源等领域.查看答案和解析>>
科目:高中化学 来源: 题型:
 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 25.40 |
| 第二次 | 20.00 | 4.00 | 29.10 |
| 第三次 | 20.00 | 3.50 | 26.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
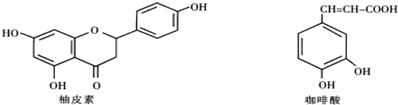
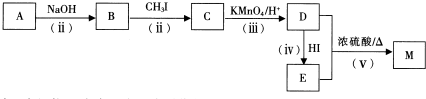

查看答案和解析>>
科目:高中化学 来源: 题型:
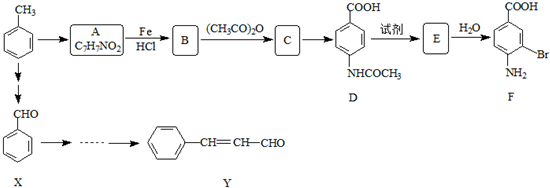
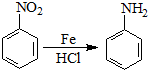

| O2 |
| 催化剂 |
| CH3CH2OH |
| 浓H2SO4 |
| 合成路线: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2O2的氧化性比Fe3+强,其还原性比Fe2+强 |
| B、在H2O2分解过程中,Fe2+和Fe3+的总量保持不变 |
| C、在H2O2分解过程中,溶液的pH逐渐下降 |
| D、H2O2生产过程要严格避免混入Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
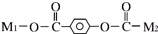 (其中M1、M2代表未知部分的结构),它在一定条件下可以发生如下转化:
(其中M1、M2代表未知部分的结构),它在一定条件下可以发生如下转化: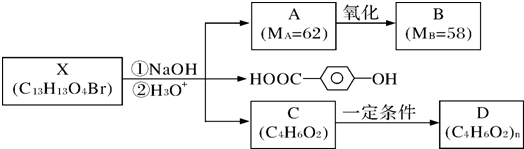
| 还原 |
| ①NaCN |
| ②H3O+ |
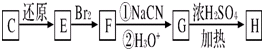
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、可用加热法分离NH4Cl(s)和I2(s) |
| B、碘水中加CCl4振荡静置后,上层为紫色,下层几乎为无色 |
| C、工业上制无水酒精通常是将生石灰与95%酒精混合后蒸馏 |
| D、蒸馏、分馏和干馏都是利用组分沸点不同而分离的方法 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com