
分类是重要的科学研究方法,下列物质归类不正确的是
A.电解质:明矾、冰醋酸、硫酸
B.酸性氧化物:CO2、SO2、NO、SiO2
C.混合物:铝热剂、矿泉水、水玻璃、漂白粉
D.同素异形体:C60、C70、金刚石
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届江西省南昌市高三上学期第四次考试化学试卷(解析版) 题型:填空题
I.元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3:4,M原子的最外层电子数与次外层电子数之比为3 :4,且M原子的质子数是Y原子的2倍;N-、Z+、X+离子半径逐渐减小;化合物XN常温下为气体,请回答下列问题:
(1)写出Y、Z、N按原子个数之比1 :1:1形成的化合物的电子式_______________。
(2)写出由X、Y、Z、M、N中某些原子形成的18电子分子和18电子离子发生氧化还原反应的离子方程式:_________________。

(3)上图表示由上述两种元素组成的气体分子在一定条件下的密闭容器中充分反应前后的转化关系,请写出该转化过程的化学方程式:________________。
Ⅱ.A、B、C、D是原子序数均小于20的四种元素。A与B同主族,且能形成BA2、BA3的型分子。B、C、D所形成的简单离子电子层结构相同,且B、C、D离子半径依次减小。请回答下列问题:
(4)D元素在元素周期表中的位置是_____。B与D所形成的化合物的化学键类型为______。
(5)将C单质的水溶液滴加到B与D所形成化合物的水溶液中,其反应的离子方程式为_。
查看答案和解析>>
科目:高中化学 来源:2016届福建省高三上学期期中考试化学试卷(解析版) 题型:实验题
NH3是重要的化工原料。
(1)用NH4Cl和Ca(OH)2制备NH3,反应发生、气体收集和尾气处理装置依次为 。

(2)某学生用下图装置对NH3与NaClO的反应进行实验探究:
操作 | 现象 |
| 液面上方出现白雾 |
资料:氨和次氯酸钠溶液反应能生成肼。肼常温下是无色液体,沸点:113℃,与水混溶,它的水溶液是一种二元弱碱。
①向水中持续通入NH3,未观察到白雾。推测现象中的白雾由N2H4小液滴形成,进行实验:用湿润的红色石蕊试纸检验白雾,试纸变蓝。该实验不能判断白雾中含有N2H4,理由是 。
②进一步实验确认了A中生成了N2H4。写出A中反应的化学方程式(N2不参与反应) ;此反应中若有5.6L氨气(标准状况下)参加反应,则转移电子的数目为_______。
查看答案和解析>>
科目:高中化学 来源:2016届陕西西安第一中学高三上学期期中考试化学试卷(解析版) 题型:实验题
某化学课外兴趣小组为探究铜跟浓硫酸的反应情况,设计了右图所示装置进行有关实验:

(1)先关闭活塞A,将6.4 g铜片和12 mL 18 mol/L的浓硫酸放在圆底烧瓶中共热至反应完成,发现烧瓶中还有铜片剩余.再打开活塞A,将气球中的氧气缓缓挤入圆底烧瓶,最后铜片完全消失。
①写出上述过程中烧瓶内发生反应的化学方程式:
打开活塞A之前 ;
打开活塞A之后 。
②B是用来收集实验中产生的气体的装置,但集气瓶内的导管未画全,请用文字叙述如何把导管补充完整 ;
(2)实际上,在打开活塞A之前硫酸仍有剩余。为定量测定余酸的物质的量,甲、乙两学生进行了如下设计:
①甲学生设计方案是:先测定铜与浓硫酸反应产生SO2的量,再通过计算确定余酸的物质的量。他测定SO2的方法是将装置A产生的气体缓缓通过装置D,从而测出装置A产生气体的体积(已折算成标准状况)。你认为甲学生设计的实验方案中D装置中试剂为: (填化学式)。
②乙学生设计的方案是:将反应后的溶液冷却后全部移入到烧杯中稀释,并按正确操配制100 mL溶液,再取20 mL于锥形瓶中,用 作指示剂,用标准氢氧化钠溶液进行滴定[已知:Cu(OH)2开始沉淀的pH约为5],选择该指示剂的理由为 ;再求出余酸的物质的量,若耗去A mol/L氢氧化钠溶液B mL,则原余酸的物质的量为 mol(用含A、B的表达式来表示)。
查看答案和解析>>
科目:高中化学 来源:2016届宁夏六盘山高级中学高三上学期期中考试化学试卷(解析版) 题型:填空题
某工业废水中可能含有如下几种阴阳离子:
阳离子 | Fe3+、Al3+、Fe2+、Ba2+、Na+ |
阴离子 | Cl-、CO32-、NO3-、SO42-、SiO32- |
现对该废水样品进行以下研究:
Ⅰ.取少量的废水于试管中,观察颜色,嗅气味,与普通水明显不同;
Ⅱ.向试管中滴加浓盐酸,有少量的无色气体生成,气体遇空气立即变为红棕色;
Ⅲ.若向II所得的溶液中加入BaCl2溶液,有白色沉淀生成;
Ⅳ.若向II所得的溶液中加入过量的NaOH溶液,有红褐色沉淀生成。过滤后向所得滤液中通入过量的CO2气体,有白色絮状沉淀生成。
根据上述实验,回答下列问题:
(1)该废水中一定含有的阴离子是 ,一定不含有的阳离子是 ;
(2)写出IV的所得滤液中通入过量的CO2气体生成白色絮状沉淀的离子方程式(只写这一个): ;
(3)若将废水中的铁元素完全转化成Fe3+,此时测得c(Fe3+)=1.0×10-2mol·L-1,要想将其转换为Fe(OH)3沉淀而除去,则应调节溶液pH约为 。(已知常温下Fe(OH)3的Ksp=1.0×10-38)
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高一上期中考试化学试卷(解析版) 题型:选择题
在下列条件下,两种气体的分子数一定相等的是
A.同质量、不同密度的N2和C2H4
B.同温度、同体积的O2和N2
C.同体积、同密度的CO和CH4
D.同压强、同体积的N2和O2
查看答案和解析>>
科目:高中化学 来源:2015-2016浙江宁波效实中学高二上期中考试化学试卷卷(解析版) 题型:选择题
室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A.在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B.分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C.把①、④两溶液等体积混合后所得溶液显酸性
D.将溶液②和溶液③等体积混合,混合后所得溶液pH=7
查看答案和解析>>
科目:高中化学 来源:2016届北京市朝阳区高三上学期期中统考化学试卷(解析版) 题型:选择题
下列图示的中国古代发明的制作过程涉及到化学变化的是
A.粮食酿醋 | B.打磨铜镜 | C.丝线织绸 | D.钻 |
|
|
|
|
查看答案和解析>>
科目:高中化学 来源:2016届山东省威海市乳山市高三上学期期中测试化学试卷(解析版) 题型:填空题
对固体表面的化学过程的研究,有助于理解各种不同的过程。
(1)根据反应: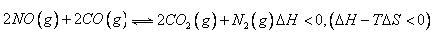
因此汽车尾气中的CO和NO会自发地生成无毒N2和CO2,但实际上有毒气体仍大量逸散到空气中,原因是: 。
(2)用CH4催化还原NOx也可以消除氮氧化物的污染。
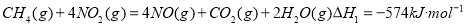
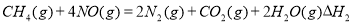
若1molCH4催化还原NO2至N2,整个过程中放出的热量为867kJ,则 = 。
= 。
(3)合成氨铁触媒主要成分是xFeO·yFe2O3,当+2价与+3价铁的物质的量之比为1:2时催化活性最高,以Fe2O3为原料制备上述催化剂,发生反应: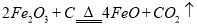 。为制得这种活性最高的催化剂,向48gFe2O3粉末中加入恰好反应的炭粉的质量为 g。
。为制得这种活性最高的催化剂,向48gFe2O3粉末中加入恰好反应的炭粉的质量为 g。
(4)探究不同催化剂对NH3还原NO反应的催化性能。

控制实验条件相同,催化反应器中装载不同的催化剂,将催化反应后的混合气体通过试管溶液(溶液体积、浓度均相同)。为比较不同催化剂的催化性能,需要测量并记录的数据是 ;尾气处理方法是: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com