
【题目】利用制磷肥的副产物氟硅酸钠(Na2SiF6)生产冰晶石(Na3AlF6)的工艺流程如下:
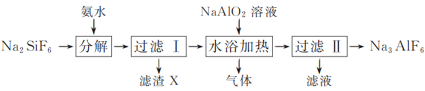
(1)分解过程发生的反应为Na2SiF6+4NH3·H2O===2NaF+4NH4F+X↓+2H2O。工业上把滤渣X叫白炭黑,其化学式为__。
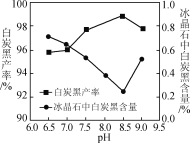
(2)分解时白炭黑产率和冰晶石纯度与pH的关系如图,分解时需要控制溶液的pH=______,能提高其分解速率的措施有____(填字母)。
A. 快速搅拌 B. 加热混合液至100 ℃ C. 减小氨水浓度
(3)流程中可循环利用的物质为_____;冰晶石在电解冶炼铝中的作用是_____。
(4)水浴加热过程中生成冰晶石的化学方程式为____。
【答案】SiO2 8.5 A NH3(NH3·H2O) 降低氧化铝的熔融温度,减少能耗 2NaF+4NH4F+NaAlO2![]() Na3AlF6↓+4NH3↑+2H2O
Na3AlF6↓+4NH3↑+2H2O
【解析】
(1)根据质量守恒定律,反应前后原子守恒,推出X的分子式;
(2)影响反应速率的外界因素:快速搅拌可加速反应速率;加热虽可以加快反应速率,但反应物是氨水,受热易分解,反应物浓度减小,故会减慢反应速率;
(3)分析流程图可知氨水是可循环利用的。
(1)由反应前后原子守恒,则X为SiO2;
(2)从图可知,pH为8.5时,冰晶石中白炭黑的含量较低,冰晶石纯度较高;能提高其分解速率的措施有:
A.快速搅拌可以加快反应速率,A正确;
B.加热混合液至100℃,氨水受热分解,反应物浓度小,化学反应速率减慢,B错误;
C.减小氨水浓度,化学反应速率减慢,C错误;
故答案为:8.5;A;
(3)第二次过滤所得滤液为氨气的水溶液,可循环使用;冰晶石降低氧化铝的熔融温度,减少能耗;故答案为:NH3(NH3·H2O);降低氧化铝的熔融温度,减少能耗;
(4)水浴加热过程中生成冰晶石的化学方程式为:
![]()


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列关于电化学的叙述正确的是( )
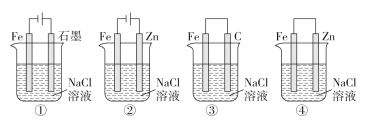
A. 图①两极均有气泡产生,滴加酚酞溶液时石墨一极变红
B. 图②装置中Fe电极参与反应发生腐蚀
C. 图③可以模拟钢铁的吸氧腐蚀,碳棒一极的电极反应式:O2+2H2O+4e-=4OH-
D. 上述4个装置中,图①、②中Fe腐蚀速率较快,图③中Fe腐蚀速率较慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应N2+3H2 ![]() 2NH3 的能量变化如图所示,该反应的热化学方程式是
2NH3 的能量变化如图所示,该反应的热化学方程式是
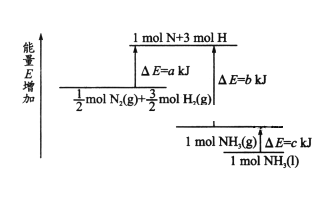
A. N2(g)+3H2(g)=2NH3(l) ![]() =2(a-b-c)kJ/mol
=2(a-b-c)kJ/mol
B. N2(g)+3H2(g)=2NH3(g) ![]() =2(b-c)kJ/mol
=2(b-c)kJ/mol
C. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(b+c-a)kJ/mol
=2(b+c-a)kJ/mol
D. 1/2N2(g)+3/2H2(g)=NH3(l) ![]() =2(a+b)kJ/mol
=2(a+b)kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应N2O4(g)![]() 2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
2NO2(g) ΔH=+57kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化的曲线如图所示。下列说法正确的是 ( )
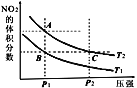
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A浅,C深
C.A、B两点气体的平均相对分子质量:A>B
D.B、C两点化学平衡常数:B>C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe2++Cl2=2Cl﹣+2Fe3+,2Br﹣+Cl2=Br2+2Cl﹣,2Fe2++Br2=2Br﹣+2Fe3+。在bL FeBr2溶液中通入amol Cl2时,使溶液中50% 的Br﹣氧化为Br2,则原FeBr2的物质的量浓度为
A. a/bmolL﹣1 B. 2a/bmolL﹣1 C. 3a/bmolL﹣1 D. 5a/bmolL﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如右图所示,下列说法正确的是
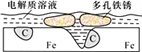
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. 每生成1mol铁锈(Fe2O3·xH2O)理论上消耗标准状况下的O233.6L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应:2SO2(g)+O2(g)![]() 2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
2SO3(g),下列措施能使反应物中活化分子百分数、化学反应速率和化学平衡常数都变化的是( )
A. 增大压强 B. 升高温度 C. 使用催化剂 D. 多充O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是中学化学常见的单质,甲、乙、丙为化合物,乙在常温常压下为无色无味的液体,元素A有可变化合价。它们之间存在如下图的所示的转化关系。由此推断:
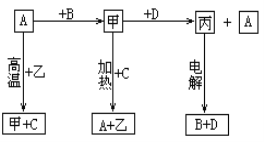
(1)甲的化学式为_____________,丙的化学式为______________。
(2)写出甲和D反应的化学方程式___________________________________________。
(3)为检验化合物甲中元素的化合价,需要用到的药品有_________________________。
A.稀硫酸 B.盐酸 C.硫氰化钾溶液 D.高锰酸钾溶液
(4)为测定A和乙高温反应后所得固体中化合物甲的质量分数。取反应后所得固体并设计以下实验:
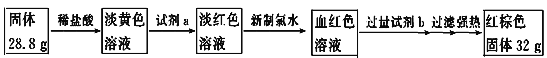
化合物甲的质量分数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可以充分说明反应P(g)+Q(g)![]() R(g)+S(g)在恒温下已达到平衡的是( )
R(g)+S(g)在恒温下已达到平衡的是( )
A. 反应容器内的压强不随时间改变
B. 反应容器内P、Q、R、S四者浓度之比为1:1:1:1
C. P的生成速率和S的生成速率相等
D. 反应容器内的气体总物质的量不随时间变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com