
【题目】萜品油烯(D)可用作香料的原料,它可由A合成得到如下所示,下列说法正确的是 ( )
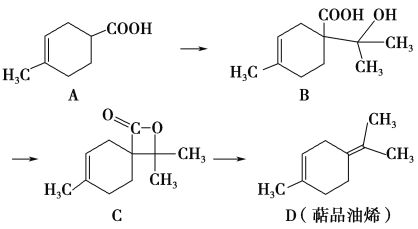
A. 有机物B的分子式为C11H19O3
B. 有机物D分子中所有碳原子一定共面
C. 1 mol有机物A中含有1.204×1024个双键
D. 有机物C的同分异构体中不可能有芳香化合物
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】维生素A是一切健康上皮组织必需的物质,缺乏维生素A时会引起儿童发育不良,导致干眼病、夜盲症、皮肤干燥等多种病症。下图是维生素A的结构。请回答:
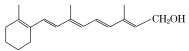
(1)维生素A的分子式为______________。
(2)下列物质在一定条件下能与维生素A反应的是____________(填标号)。
A.溴水 B.酸性KMnO4溶液 C.氢溴酸 D.金属钠
(3)1 mol维生素A分子最多可跟________ mol H2发生加成反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,下图为两套实验装置。
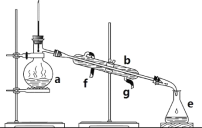
(1)写出下列仪器的名称:a.____________,b.___________,
(2)若利用装置分离四氯化碳和酒精的混合物,还缺少的仪器是__________,将仪器补充完整后进行实验,温度计水银球的位置在______处。
Ⅱ.配制一定物质的量浓度的溶液是化学实验室的基本实验操作之一。请回答下列问题:
(3)配制0.5 mol/L的硫酸溶液450 mL,需用量筒量取质量分数98%、密度1.84 g/cm3的浓硫酸的体积为_____mL,如果实验室有15 mL、20 mL、50 mL 量筒,应最好选用_____mL量筒。
(4)配制上述溶液,除用到量筒、烧杯、玻璃棒外,还需要的两种玻璃仪器是_____、_______。
(5)配制时,其正确的操作顺序是__________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有水的烧杯中加入浓硫酸稀释
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(6)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)。若没有进行A操作___________;若定容时俯视刻度线_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是
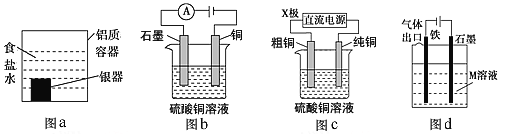
A. 利用图a装置处理银器表面的黑斑Ag2S,银器表面的反应为Ag2S+2e-=2Ag+S2-
B. 图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C. 图c中的X极若为负极,则该装置可实现粗铜的精炼
D. 图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制得的氮化铝(AlN)产品中常含有少量Al4C3、Al2O3、C等杂质。某同学设计如下实验分别测定氮化铝(AlN样品中AlN和Al4C3的质量分数(忽略NH3在强碱性溶液中的溶解)。
(1)实验原理:①Al4C3与硫酸反应可生成CH4;
②AlN溶于强酸产生铵盐,溶于强碱生成氨气,请写出AlN与NaOH溶液反应的化学方程式:____________。
(2)实验装置(如图所示,量气管为碱式滴定管改装)
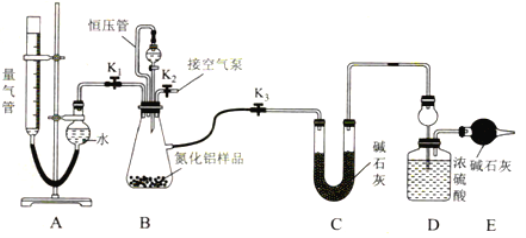
连好装置后,首先应进行的操作是________。
(3)实验过程:称得装置D的初始质量为y g;称取x g AlN样品置于装置B锥形瓶中,各装置中加入相应药品,重新连好装置;读取量气管的初始读数为a mL(量气装置左右液面相平)。
①欲首先测量Al4C3质量分数的有关数据,对三个活塞的操作是________。
②若无恒压管,对所测气体体积的影响是________(填“偏大”“偏小”或“无影响”)
③量气管中液面不再发生变化,说明反应已经结束。读取读数之前,应对量气管进行调整量气管高度,使左右两边液面相平 ,若量气管中的液面高于右侧球形容器中的液面,所测气体的体积______(填“偏大”“偏小”或“无影响”)。
④记录滴定管的读数为b mL(已知:该实验条件下的气体摩尔体积为Vm L·mol-1),则Al4C3的质量分数为______(用含a、b、x、y、Vm的代数式表示)。
⑤测量AlN质量分数的数据:首先关闭活塞 K1 ,打开活塞K3,通过分液漏斗加入过量___,与装置B瓶内物质充分反应;反应完成后,____(填入该步应进行的操作),最后称得装置D的质量为z g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组的同学用如图所示装置研究有关电化学的问题。当闭合该装 置的开关时,观察到电流表的指针发生了偏转。

请回答下列问题:
(1)甲池为_____(填“原电池”“电解池”或“电镀池”),通入 CH3OH 电极的电极反应为_____。
(2)乙池中 A(石墨)电极的名称为_____(填“正极”“负极”或“阴极”“阳极”),总反应为__________。
(3)若甲、乙、丙溶液体积均为500 mL,当乙池中 B 极质量增加 5.4 g 时,甲池中理论上消耗 O2 的体积为_____mL(标准状 况),乙池中溶液PH=_______,丙池中_____(填“C”或“D”)极析出_____g 铜。
(4)若丙中电极不变,将其溶液换成 NaCl 溶液,开关闭合一段时间后,甲中溶液的 pH将_____(填“增大”“减小”或“不变”,下同),丙中溶液的 pH 将______。
(5)某溶液中可能含有下列离子中的两种或几种:Ba2+、H+、SO42-、 SO32- 、HCO3-、 Cl-。
①当溶液中有大量H+存在时,则不可能有_______________________离子存在。
②当溶液中有大量Ba2+存在时,溶液中不可能有_________________离子存在。
③采用惰性电极从上述离子中选出适当离子组成易溶于水的电解质,对其溶液进行电解若两极分别放出气体,且体积比为1∶1,则电解质化学式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。
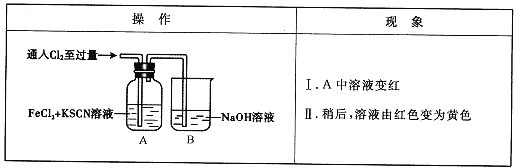
(1)B中反应的离子方程式是____。
(2)A中溶液变红的原因是____。
(3)为了探究现象II的原因,甲同学进行如下实验。
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在_____。
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液。
甲同学的实验证明产生现象Ⅱ的原因是SCN—与Cl2发生了反应。
(4)甲同学猜想SCN—可能被Cl2氧化了,他又进行了如下研究。
资料显示:SCN—的电子式为![]()
①甲同学认为SCN—中碳元素没有被氧化,理由是_________。
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN—中被氧化的元素是__________。
③通过实验证明了SCN—中氮元素转化为NO3-,他的实验方案是____。
④若SCN—与Cl2反应生成1 mol CO2,则转移电子的物质的量是______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锑(Sb)在自然界一般以硫化物的形式存在,我国锑的蕴藏量占世界第一。从硫化物中提取单质锑一般是先在高温下将硫化物转化为氧化物,再用碳还原:2Sb2S3+3O2+6Fe=Sb4O6+6FeS①;Sb4O6+6C=4Sb+6CO②。下列说法正确的是( )
A. 反应②说明高温下Sb还原性比C强
B. 反应①中每生成1 mol FeS时,共转移2mol电子
C. 每生成1 mol Sb时,反应①与反应②中还原剂的物质的量之比为4︰3
D. 反应①②中氧化剂分别是Sb2S3、Sb4O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
已知:C(s)+2H2(g)=CH4(g) ΔH=-75 kJ·mol1
C(s)+O2(g)=CO2(g) ΔH=-394 kJ·mol1
C(s)+![]() O2(g)===CO(g) ΔH=-111 kJ·mol1
O2(g)===CO(g) ΔH=-111 kJ·mol1
①该催化重整反应的ΔH=____ kJ·mol1。有利于提高CH4平衡转化率的条件是____(填标号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
②某温度下,在体积为2 L的容器中加入2 mol CH4、1 mol CO2以及催化剂进行重整反应,达到平衡时CO2的转化率是50%,其平衡常数为______mol2·L2。下列可判断该反应达到平衡的是_________(填标号)。
A.单位时间内生成n mol的CH4,同时生成n mol的H2 B.v(CH4):v(CO)=1:2
C.容器中混合气体的密度不再发生变化 D.容器中的压强保持不变
(2)CO2可以被(NH4)2CO3溶液捕获,反应为(NH4)2CO3(aq)+H2O(l)+CO2(g)=2NH4HCO3(aq) ΔH。为研究温度对(NH4)2CO3捕获CO2效率的影响,在某温度T1下,将一定量的(NH4)2CO3溶液置于密闭容器中,并充入一定量的CO2气体(用氮气作为稀释剂),在t时刻,测得容器中CO2气体的浓度。然后分别在温度为T2、T3、T4、T5下,保持其他初始实验条件不变,重复上述实验,经过相同时间测得CO2气体浓度,其关系如图1,则ΔH______(填“>”、“=”或“<”)0。
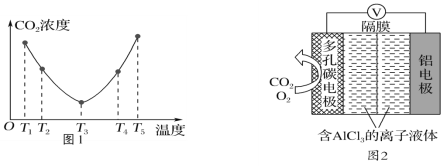
(3)O2辅助的Al-CO2电池工作原理如图2所示。该电池电容量大,能有效利用CO2,电池反应产物Al2(C2O4)3是重要的化工原料。
电池的负极反应式:________________________________。
电池的正极反应式:6O2+6e-=6O;6CO2+6O=3C2O42-+6O2
反应过程中O2的作用是_________________。
(4)CO2可以被NaOH溶液捕获。若所得溶液c(HCO3-):c(CO32-) = 2∶1,溶液pH=________。(室温下,H2CO3的K1=4×10-7;K2=5×10-11)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com