
【题目】(1)等质量的CO和SO2分别装入同温同体积的容器,所含氧原子之比___,压强之比___。
(2)在标准状况下,由CO和CO2组成的混合气体8.96L,质量是16g。此混合物中CO和CO2的物质的量之比是___,混合气体的平均摩尔质量是___。
(3)将标准状况下aL的HCl(g)溶于1000g水,得到的盐酸的密度为bg/cm3,则该盐酸的物质的量浓度为___mol·L-1。
(4)1.204╳1023个NH4+的物质的量为__mol,质量为____g.
【答案】8:7 16:7 1:3 40g/mol 1000ab/(36.5a+22400) 0.2 3.6
【解析】
(1)等质量的CO和SO2分别装入同温同体积的容器,所含氧原子之比=8:7,相同条件下气体的压强之比等于物质的量之比,即二者的压强之比为=16:7;
(2)在标准状况下,由CO和CO2组成的混合气体8.96 L,物质的量是![]() =0.4mol,质量是16g,设此混合物中CO和CO2的物质的量分别是xmol、ymol,则x+y=0.4、28x+44y=16,解得x=0.1,y=0.3,即二者的物质的量之比是1:3,混合气体的平均摩尔质量是
=0.4mol,质量是16g,设此混合物中CO和CO2的物质的量分别是xmol、ymol,则x+y=0.4、28x+44y=16,解得x=0.1,y=0.3,即二者的物质的量之比是1:3,混合气体的平均摩尔质量是![]() =40 g/mol;
=40 g/mol;
(3)标准状况下的aL HCl(g)的物质的量为![]() =
=![]() mol 氯化氢的质量为
mol 氯化氢的质量为![]() mol×36.5g/mol=
mol×36.5g/mol=![]() g 所以溶液质量为1000g+
g 所以溶液质量为1000g+![]() g=(1000+
g=(1000+![]() )g。所以溶液的体积为
)g。所以溶液的体积为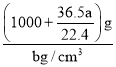 =
=![]() mL。所以溶液浓度为
mL。所以溶液浓度为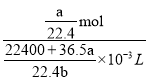 =
=![]() mol/L;
mol/L;
(4)n(NH4+)=![]() =
=![]() =0.2mol,m(NH4+)=nM=0.2mol×18g/mol=3.6g。
=0.2mol,m(NH4+)=nM=0.2mol×18g/mol=3.6g。


科目:高中化学 来源: 题型:
【题目】下列溶液一定呈中性的是
A. pH=7
B. pH=3的盐酸与pH=11的氨水等体积混合后
C. 0.1mol/LNaOH溶液与0.05mol/LH2SO4溶液混合后
D. C(OH-)=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g)△H=+180.5kJ/mol,N2(g)+3H2(g) ![]() 2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
2NH3(g)△H=-92.4kJ/mol,2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol,写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为_________。
(2)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。现以H2、O2、熔融盐Na2CO3组成的燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。

写出石墨I电极上发生反应的电极反应式_______________________________,在电解池中生成N2O5的电极反应式为__________________________________。
(3)以甲醇燃料电池为电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为________L。
(4)在一定体积的密闭容器中,进行如下化学反应: N2(g)+3H2(g) ![]()
![]() 2NH3(g),其化学平衡常数K与温度t的关系如下表:
2NH3(g),其化学平衡常数K与温度t的关系如下表:
t/K | 298 | 398 | 498 | … |
K/(mol·L-1)2 | 4.1106 | K1 | K2 | … |
完成下列问题:
①已知该反应能够自发进行,试比较K1、K2的大小:K1_______ K2(填“>”、“=”或“<”);
②在同温同压时判断该反应达到化学平衡状态的依据是_________(填序号);
A.2v(H2)(正)=3v(NH3)(逆) B.2v(N2)(正)=v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(5)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式__________________________________;
②盐酸肼水溶液中离子浓度的排列顺序不正确的是__________(填序号)。
A.c(Cl-)>c(N2H62+)> c(OH-)> c(H+)
B.c(Cl-)>c([N2H5·H2O]+)> c(H+)>c(OH-)
C.2 c(N2H62+)+ c([N2H5·H2O]+)+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铜与6molL-1硝酸反应的气态产物中是否含NO2,进行如下实验。

已知:FeSO4+NO ![]() [Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量2+时突显明显棕色。
[Fe(NO)]SO4(棕色),该反应较缓慢,待生成一定量2+时突显明显棕色。
(1)实验前需检验装置的气密性,简述操作_____________________________________。
(2)仪器a的名称____________
(3)实验开始时先将Y形试管向盛有块状固体b的支管倾斜,缓慢滴入稀硝酸,该实验操作的目的是_________;
(4)证明有NO2的实验现象___________________________________
(5)装置C的作用________,反应离子方程式____________。
(6)测定化学试剂绿矾(FeSO4·7H2O)纯度的方法:称取绿矾3.000g置于锥形瓶中,加入100mL蒸馏水,加入10mLH2SO4和5mLH3PO4,用0.1000molL-1KMnO4溶液滴定至终点,消耗KMnO4溶液20.00mL。KMnO4溶液盛放在棕色_____式(填“酸”或“碱”)滴定管中,列式计算绿矾的纯度_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D是中学化学常见物质,它们在一定条件下有A+B→C+D的转化关系。
(1)若A为金属铝,B为氧化铁,该反应的一种用途是_______________。
(2)若A是一种能使湿润的红色石蕊试纸变蓝的气体,且该反应是工业上制取硝酸的重要反应之一,该反应的化学反应方程式为____________________________。
(3)若A是淡黄色粉末,常用作供氧剂,C为强碱,则该反应的化学反应方程式为_______。
(4)若A、B、D都是有机化合物,其中A、B是家庭厨房中常见调味品的主要成分,且A 的相对分子质量比B大14。
①该反应的化学反应方程式为_____________________。
②某种以B为反应物的新型电池如图所示,该电池的负极的电极反应式为_________。

(5)ClO2可将弱酸性废水中的Mn2+转化为MnO2而除去,同时ClO2被还原为Cl—,该反应的离子方程式为________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列反应:
①2H2O+Cl2+SO2=H2SO4+2HCl
②2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
针对上述两个反应回答:
(1)用单线桥标出①中电子转移的方向和数目_____;
(2)写出②的离子化学方程式____;
(3)Cl2、SO2和KMnO4的氧化性由强到弱的顺序为____;
(4)反应②中氯化氢表现出的性质是____。
a.还原性 b.酸性 c.氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,Ksp(BaSO4)=1×10-10 mol2·L-2,Ksp(BaCO3)=5.1×10-9 mol2·L-2。在该温度下,下列说法不正确的是( )
A. 因为Ksp(BaCO3)>Ksp(BaSO4),所以BaSO4比BaCO3溶解度更小
B. 若误饮c(Ba2+)=1.0×10-5mol·L-1的溶液时,会引起Ba2+中毒
C. 向同浓度Na2SO4和Na2CO3的混合液中滴加BaCl2溶液,BaSO4先析出
D. 在BaSO4的饱和溶液液中,c(SO42-)=1.0×10-5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应:A(s)+3B(g) ![]() 2C(g),下列说法说明达到平衡状态的是( )
2C(g),下列说法说明达到平衡状态的是( )
①C的生成速率和C的分解速率相等;②单位时间内生成a mol A,同时生成3a mol B;③气体密度不再变化;④混合气体的总压强不再变化;⑤A、B、C的物质的量之比为1∶3∶2;⑥C的体积分数不再变化
A. ②④⑤ B. ①③④⑥
C. ①②④⑥ D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com