
| A. | 5g H2和5g N2 | B. | 224mlN2(标准状况)和0.1molCO | ||
| C. | 16gO2和0.5molSO2 | D. | 22.4LH2O(标准状况)和1molO2 |
分析 所含分子数相同,则各分子物质的量相等.
A.根据n=$\frac{m}{M}$判断;
B.根据n=$\frac{V}{{V}_{m}}$计算氮气物质的量;
C.根据n=$\frac{m}{M}$计算氧气物质的量;
D.标况下水不是气体,22.4L水的物质的量不是1mol.
解答 解:A.氢气、氮气的摩尔质量不相等,根据n=$\frac{m}{M}$可知,5g H2和5g N2的物质的量不相等,二者含有分子数目不相等,故A错误;
B.标况下224mL氮气物质的量为$\frac{0.224L}{22.4L/mol}$=0.01mol,与0.1molCO含有分子数目不相等,故B错误;
根据n=$\frac{V}{{V}_{m}}$计算氮气物质的量;
C.16gO2的物质的量为$\frac{16g}{32g/mol}$=0.5mol,与0.5molSO2含有分子数目相等,故C正确;
D.标况下水不是气体,22.4L水的物质的量不是1mol,与1molO2含有分子数目不相等,故D错误,
故选:C.
点评 本题考查物质的量有关计算,比较基础,注意气体摩尔体积的使用条件与对象.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂没有固定的熔点和沸点,油脂是混合物 | |
| B. | 天然油脂大多是由混甘油酯分子构成的混合物 | |
| C. | 油脂的主要成分是高级脂肪酸的甘油酯,是酯的一种 | |
| D. | 油脂不能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:
在一定温度下,冰醋酸(即纯醋酸)加水稀释过程中,溶液的导电能力如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用蒸馏的方法制取蒸馏水 | |
| B. | 用酒精萃取饱和碘水中的碘单质 | |
| C. | 使用分液漏斗分离水和四氯化碳的混合物 | |
| D. | 过滤时玻璃棒的末端应轻轻靠在三层的滤纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100ml | B. | 50ml | C. | 1000ml | D. | 500ml |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
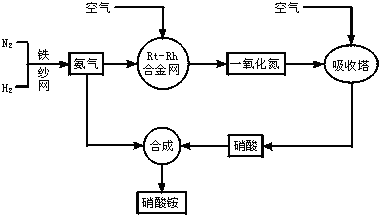
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向某分散系中加入一种电解质后产生沉淀,则该分散系一定属于胶体 | |
| B. | 氧化还原反应的本质是电子的转移,外观特征是化合价的变化 | |
| C. | 摩尔是一种可以把物质的宏观量和微观粒子的数量联系起来的物理量 | |
| D. | 某物质溶于水后能够导电,则该物质一定是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com