
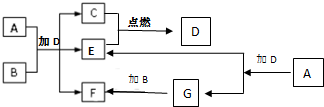
 下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.
下列框图中各物质均为中学常见物质.A是淡黄色固体化合物,B、C、E为单质,其中C、E为气体,B为金属.常温、常压下D为无色液体.| 3.9g |
| 78g/mol |
| 1 |
| 2 |


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
| ||
| ||
| ||
| A、氧化性(酸性溶液):PbO2>Fe3+>S |
| B、还原性(碱性溶液):Fe(OH)2>KCl>Cl2 |
| C、酸性(水溶液):H2S>H2SO4>H2SeO4>HN3 |
| D、热稳定性:BaCO3>MgCO3>CuCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入适量四氯化碳, | 假设1正确 |
| ②向溶液中加入 | 假设2正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Mg2+、Ba2+、Cl-、NO3- |
| B、K+、AlO2-、Cl-、SO42- |
| C、Na+、K+、NO3-、HCO3- |
| D、Al3+、Cl-、CO32-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| A、遇苯酚变紫色的溶液:Na+、Mg2+、SO42-、Cl- |
| B、0.1 mol?L-1 (NH4)2Fe(SO4)2溶液中:K+、Cu2+、Cl-、MnO4- |
| C、使甲基橙变红色的溶液:NH4+、Cu2+、ClO-、Cl- |
| D、0.1mol?L-1 NaHCO3溶液:K+、AlO2-、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/(min) | n(A)/( mol) | n(B)/( mol) | n(C)/( mol) |
| 0 | 1 | 3 | 0 |
| 第2 min | 0.8 | 2.6 | 0.4 |
| 第4 min | 0.4 | 1.8 | 1.2 |
| 第6 min | 0.4 | 1.8 | 1.2 |
| 第8 min | 0.1 | 2.0 | 1.8 |
| 第9 min | 0.05 | 1.9 | 0.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

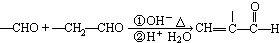

| NaCN |
| H+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com