
科目:高中化学 来源: 题型:
【题目】如表是A、B、C、D四种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色; ②填充模型为 ③能与水在一定条件下反应生成C. |
B | ①由C、H两种元素组成; ②球棍模型为 |
C | ①由C、H、O三种元素组成; ②能与Na反应,但不能与NaOH溶液反应; ③能与D反应生成一种有香味的油状物. |
D | ①由C、H、O三种元素组成; ②球棍模型为 |
回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的结构简式是______.
A与水在一定条件下反应生成C的化学方程式是______
(2)B具有的性质是______.
A.无色无味液体,密度比水大 B.与酸性KMnO4溶液和溴水反应褪色
C.有毒,不溶于水 D.任何条件下不与氢气反应
(3)A与氢气发生加成反应后生成物质E,E的组成符合通式CnH2n+2.
当n=______时,这类有机物开始出现同分异构体.
A.2 B.4 C.3 D.5
写出在浓硫酸作用下,B与浓硝酸反应的化学方程式:______.
(4)C与D反应生成的产物名称是______,该反应的反应类型为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组在其他条件不变时,改变某一条件对反应[可用aA(g)+bB(g)![]() cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )
cC(g)表示的化学平衡的影响,得到如下图象(图中p表示压强,T表示温度,n表示物质的量,α表示平衡转化率)。根据图象,下列判断正确的是( )

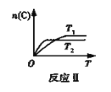


A.反应I:若p1>p2,则此反应只能在高温下自发进行
B. 反应Ⅱ:此反应的ΔH<0,且T1<T2
C.反应Ⅲ:表示t1时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大B的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水开发利用的部分过程如图所示。下列说法错误的是( )

A.向苦卤中通入Cl2是为了提取溴
B.粗盐可采用除杂和重结晶等过程提纯
C.工业生产中常选用NaOH作为沉淀剂
D.富集溴一般先用空气和水蒸气吹出单质溴,再用SO2将其还原吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分析下图所示的四个原电池装置,其中结论正确的是

A.①②中Mg作负极,③④中Fe作负极
B.②中Mg作正极,电极反应式为6H2O+6e-===6OH-+3H2↑
C.③中Fe作正极,电极反应式为Fe-2e-===Fe2+
D.④中Cu作正极,电极反应式为2H++2e-===H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素为原子序数依次增大的短周期元素。A为原子半径最小的元素,A和B可形成4原子10电子的分子X;C的最外层电子数是内层的3倍;D原子的最外层电子数是最内层电子数的一半;E是地壳中含量最多的金属元素;F元素的最高正价与最低负价代数和为6。请回答下列问题:(用化学用语填空)
(1)B、C、D、E、F五种元素原子半径由大到小的顺序是__________________。
(2)A和C按原子个数比1∶1形成4原子分子Y,Y的结构式是____________。
(3)B、C两种元素的气态氢化物结合质子的能力由大到小的顺序为________(填化学式),用一个离子方程式证明________________。
(4)分子X的电子式是___________;D可以在液态X中发生类似于与A2C的反应,写出反应的化学方程式_________________________________。
(5)实验证明,熔融的EF3 不导电,其原因是__________________________。
(6)E的单质可溶于A、C、D形成的化合物Z的水溶液中,写出该反应的离子方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在其它条件相同时,试管①和②在对应的试剂(或条件)不能完成实验目的是

实验目的 | 试剂(或条件) | |
A | 温度对H2O2分解反应速率的影响 | ①热水浴②冰水浴 |
B | 用稀硫酸比较铝和铁的金属活动性 | ①铝粉②铁钉 |
C | 用酸化的AgNO3溶液检验海水中Cl-能否蒸馏除去 | ①海水②蒸馏所得液体 |
D | 用Na块检验乙醇分子存在不同于烃分子里的氢原子 | ①乙醇②煤油 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:

有关物质的溶度积常数
物质 | Fe(OH)2 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 |
Ksp | 8.0×10-16 | 4.0×l0-38 | 4.5×10-33 | 1.9×l0-13 |
(1)已知,锂电池放电正极的电极反应为:LiMn2O4+e-+Li+= Li2Mn2O4,则锂电池正极材料锰酸锂中,锰元素的化合价为________。
(2)流程中,FeSO4的作用是_______,MnO的作用是_________,当滤液中的pH为6时,滤液中所含铝离子的浓度为___________。
(3)采用下图装置电解,离子交换膜将电解池分隔为阳极室和阴极室,两室的溶液分别为硫酸钠溶液和制得的硫酸锰溶液,则阴极室中的溶液为________;电解产生的MnO2沉积在电极上,该电极反应式为_________。

(4)若将上述装置中的硫酸钠溶液换为软锰矿的矿浆,并加入适量的硫酸铁及硫酸,可一次性完成软锰矿的浸出反应与电解沉积MnO2反应,电解时,Fe3+先放电生成Fe2+,产生的Fe2+再与矿浆中的 MnO2反应,周而复始,直至矿浆中的MnO2完全浸出。则Fe2+与矿浆中MnO2反应的离子方程式为__________。
(5)写出高温煅烧生成锰酸锂的化学方程式___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com