
分析 非金属性强弱比较的一般规律是:①根据氧化还原反应判断:同一化学反应,氧化剂的氧化性强于氧化产物的氧化性;②由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.③由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).④非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证.
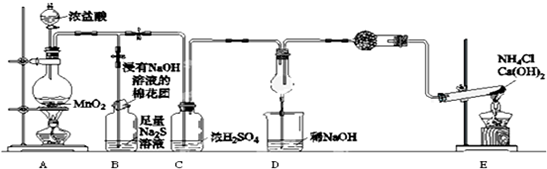
为验证非金属元素氯的氧化性强于硫,该实验通过氯气把硫化钠溶液中的硫离子氧化为S单质说明,为验证非金属元素氯的氧化性强于氮,通过氯气能把氨气氧化生成氮气和氯化氢说明,实验装置中,A制取氯气:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O,浓盐酸易挥发,经过浓硫酸干燥的氯气中扔混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢,需要在C之前加装洗气装置,为该实验装置设计缺陷,B装置为为验证非金属元素氯的氧化性强于硫,B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性,反应为:Cl2+S2-=S↓+2Cl-,装置C进行干燥氯气,盛放氢氧化钠的烧杯吸收尾气,装置E为:氯化铵和氢氧化钙固体加热反应生成氨气,反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$2NH3↑+2H2O+CaCl2;装置D氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,验证非金属元素氯的氧化性强于氮.
(1)此反应装置为浓盐酸和二氧化锰共热制备氯气,以此写出化学方程式;
(2)B中出现黄色浑浊现象,说明有S沉淀生成,氯气的氧化性大于S的氧化性;
(3)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气;
(4)装置E为实验室制取氨气的装置,氯气能把氨气氧化生成氮气和氯化氢,氯化氢与氨气反应生成氯化铵,故现象为冒白烟;
(5)浓盐酸易挥发,经过浓硫酸干燥的氯气中仍混有少量氯化氢气体,因此需要在C加一吸收装置除掉氯化氢;
(6)依据非金属性强弱比较的一般规律进行验证.
解答 解:(1)反应装置A为浓盐酸和二氧化锰共热制备氯气的装置,其离子方程式为:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:MnO2+4H++2Cl$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(2)反应制备的氯气通入B之后,B中出现黄色浑浊现象,说明氯气把硫化钠溶液中的硫离子氧化为S单质,离子方程式为Cl2+S2-=S↓+2Cl-,
故答案为:Cl2+S2-=S↓+2Cl-;
(3)氯气污染环境,浸有NaOH溶液的棉花团可以吸收多余的氯气,反应为:Cl2+2NaOH═NaCl+NaClO+H2O,
故答案为:吸收多余的氯气;
(4)通E装置是制备氨气,氯气能把氨气氧化生成氮气和氯化氢,生成的氯化氢和氨气结合生成氯化铵,从而冒白烟,因此实验的现象是产生大量白烟,反应的方程式是8NH3+3Cl2=6NH4Cl+N2,
故答案为:产生大量白烟;8NH3+3Cl2=6NH4Cl+N2;
(5)盐酸易挥发,所以生成氯气中含有氯化氢气体,氯化氢也能直接和氨气结合冒白烟,所以需要在C之前连接一盛有饱和食盐水的装置以除去氯化氢气体,装置图为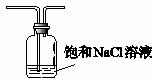 ,
,
故答案为:氯化钠;
(6)非金属性强弱比较的一般规律是:①由对应氢化物的稳定性判断:氢化物越稳定,非金属性越强.②由最高价氧化物对应水化物的酸性来判断:酸性越强,非金属越强.(除氟元素之外).③非金属单质与具有可变价金属的反应.能生成高价金属化合物的,其非金属性强,据此可以验证,所以还可用以下方法能证明氧化性Cl2>S,方法一:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS;方法二:相同温度下相同状态的HCl的稳定性大于H2S;方法三:最高价氧化物对应的水化物的酸性HClO4 大于H2SO4.用化学方程式表示选择方法一,
故答案为:2Fe+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2FeCl3、Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
点评 本题考查实验方案的设计与评价,考查了氯气、氨气的实验室制法及性质的检验,明确制备原理及物质的性质是解题关键,题目难度中等.


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:选择题
| 实验目的 | 实验方案 | |
| A | 检验碳与浓硫酸反应后的气体产物 | 将产生的气体依次通过无水CuSO4、澄清石灰水和品红溶液 |
| B | 证明蛋白质在某些无机盐溶液作用下发生变性 | 向鸡蛋清溶液中加入饱和硫酸钠溶液,有沉淀析出;再把沉淀加入蒸馏水中 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入适量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 证明非金属性S>C | 测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na参加氧化还原反应时电子转移NA | |
| B. | 3.2g SO2与2.3g NO2所含有的氧原子数相等 | |
| C. | 标准状况下,2.24L H2O含有的O原子数为0.1NA | |
| D. | 1L 0.1mol/LMgCl2溶液中Cl-离子数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | As的最高正价为+3价 | B. | AsH3的稳定性比PH3强 | ||
| C. | 氧化物的水化物酸性:As<N | D. | As是第4周期第VA族元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应(1)中SO2氧化性比HI强 | |
| B. | 循环过程中不需要补充H2O | |
| C. | 循环过程H2O作催化剂 | |
| D. | 循环过程中产生1mol H2的同时产生0.5mol O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在一定条件下能与溴发生取代反应 | |
| B. | 能被高锰酸钾酸性溶液氧化 | |
| C. | 在加热和催化剂作用下,能与氢气反应 | |
| D. | 所有碳原子不可能共面且不能与氢溴酸发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:
乙酸正丁酯是一种重要化工原料,某实验小组利用图1、图2装置合成乙酸正丁酯(夹持装置已略去),发生的化学反应为:| 相对分子质量 | 沸点/℃ | 密度(g/cm3) | 水中溶解度 | |
| 正丁醇 | 74 | 117.2 | 0.80 | 微溶 |
| 乙酸 | 60 | 118.1 | 1.05 | 易溶 |
| 乙酸正丁酯 | 116 | 126.5 | 0.90 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③中的氧化产物分别是I2、Fe3+、CoCl2 | |
| B. | 根据以上方程式可以得到氧化性Cl2>Fe3+>Co2O3 | |
| C. | 在③反应中当1molCo2O3参加反应时,2molHCl被氧化 | |
| D. | 可以推理得到Cl2+FeBr2═FeCl2+Br2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com