
| A. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(1)△H=-20Q kJ/mol | |
| B. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-40Q kJ/mol | |
| C. | $\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(g)△H=-20Q kJ/mol | |
| D. | C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(g)△H=-40Q kJ/mol |
分析 生成的CO2与足量澄清石灰水反应得到5g沉淀,n(CO2)=$\frac{5g}{100g/mol}$=0.05mol,则生成1mol二氧化碳气体和液态水,放出的热量为$\frac{QkJ}{0.05}$=20Q kJ,结合物质的量与热量成正比及物质的状态来解答.
解答 解:生成的CO2与足量澄清石灰水反应得到5g沉淀,n(CO2)=$\frac{5g}{100g/mol}$=0.05mol,则生成1mol二氧化碳气体和液态水,放出的热量为$\frac{QkJ}{0.05}$=20Q kJ,
则热化学方程式为$\frac{1}{2}$C2H5OH(1)+$\frac{3}{2}$O2(g)=CO2(g)+$\frac{3}{2}$H2O(l)△H=-20Q kJ/mol或C2H5OH(1)+3O2(g)=2CO2(g)+3H2O(l)△H=-40Q kJ/mol,
故选B.
点评 本题考查热化学方程式,为高频考点,把握物质的量与热量的关系、物质的状态为解答该题的关键,侧重分析与应用能力的考查,注意燃烧热中水为液态,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Cl-、SO42- | B. | Na+、AlO2-、NO3-、CO32- | ||
| C. | Na+、H+、NO3-、SO42- | D. | Na+、Ag+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热氯化铁溶液的颜色变深 | |
| B. | NaHCO3做发酵粉时加入柠檬酸后效果更好 | |
| C. | 0.1 mol/L AlCl3溶液中c(Al3+)<0.1 mol/L | |
| D. | 常温下,CaCO3的饱和溶液pH约为9.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的标准燃烧热为-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30 Mpa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6kJ•mol-1 | |
| C. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件的△H不同 | |
| D. | 101 kPa时,硫的标准燃烧热与硫完全燃烧时的物质的量无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
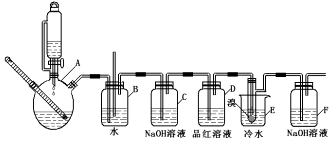
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 | 红棕色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 | 3.10 |
| 沸点/℃ | 78.5 | 132 | 34.6 | 58.8 |
| 熔点/℃ | -l30 | 9 | -1l6 | -7.2 |
| 水溶性 | 混溶 | 难溶 | 微溶 | 可溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 30mL 1.0mol/L NaCl溶液 | B. | 10mL2.0mol/L FeCl3溶液 | ||
| C. | 50mL1.5mol/L MgCl2溶液 | D. | 100mL1.0mol/L HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与等体积、pH=3的盐酸比较,跟足量锌粒反应产生的H2更多 | |
| B. | 水稀释到原体积的10倍后,溶液pH变为4 | |
| C. | 加入少量乙酸钠固体,溶液pH降低 | |
| D. | 加水稀释后,溶液中c(H+)和c(OH-)都减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com