
【题目】下列属于酸的是
A.HClO3B.Na2CO3C.SO2D.KOH
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】欲提纯混有硫酸钠、碳酸氢铵的氯化钠固体,某学生设计了如下方案:

请根据操作流程回答下列问题:
(1)操作①在加热时应选择_________盛装混合物(填仪器名称)。
(2)进行操作②后,判断SO42-已沉淀完全的方法是_________。
(3)操作③的离子方程式为_________。
(4)操作④的目的是_________。
(5)实验室进行操作⑤的具体步骤是_________。
(6)某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、_________。
②下列操作会使所配氯化钠溶液浓度偏小的是_________(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组利用硝酸和废铜屑(含Cu和CuO)作为原料制备硝酸铜,设计的流程如下:
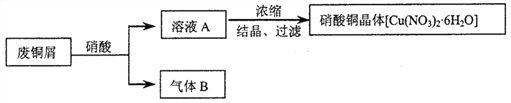
(1)某次实验使用了废铜屑共24g,用一定浓度的硝酸100mL完全溶解这些废铜屑时,共收集到标准状况下B气体6.72L(其中NO2和NO的体积比为2∶1)。请通过计算回答下列问题:
①废铜屑中铜和氧化铜的物质的量之比_____________。
②若测得溶液A中H+的浓度为1mol·L-1,则原硝酸的物质的量浓度为________________。(假设反应前后溶液的体积不变)
(2)上述制备方案中产生的气体B,既造成原料的浪费,也污染了环境。请你设计方案解决上述问题___________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸毗醛素是细胞的重要组成部分,其结构式如下,下列有关叙述不正确的是

A. 该物质是一种磷酸酯类化合物
B. 该有机物能发生银镜反应
C. 该有机物可以发生取代、加成、氧化、还原、聚合反应
D. 1mol该有机物与NaOH溶液反应,最多消耗5mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向20mL 0.1mol/L的氢氟酸溶液中逐滴加入0.1mol/L NaOH溶液,滴加过程中混合溶液的pH变化曲线如图所示,回答下列问题: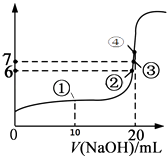
(1)若0.1mol/L的氢氟酸溶液中有0.1%的HF发生电离,则溶液的pH=;
(2)滴加NaOH溶液至恰好反应的过程中,水的电离程度(填写“逐渐增大”、“不变”、“逐渐减小”);
(3)①点时,NaOH加入了10mL,此时溶液中各种微粒(不包括水)的浓度由大到小的顺序是;
(4)③点时pH=7,此时溶液中c(F﹣)c(Na+)(填写>、<或=);
(5)④点时,NaOH加入了20mL,此时溶液中有两种微粒浓度之和等于0.05mol/L,这两种微粒是和;
(6)若以NaOH溶液为标准液,通过滴定的方法测定另一未知浓度的HF溶液的浓度,推测最好使用的指示剂为(常见指示剂的变色范围是:甲基橙3.1~4.4,酚酞8~10).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于容量瓶的使用,下列操作正确的是( )
A.使用前要先检查容量瓶是否漏液
B.用蒸馏水洗涤后必须要将容量瓶烘干
C.为了方便快捷,可以直接在容量瓶内进行固体溶解
D.定容结束后,为了使溶液均匀,手握瓶颈,左右振荡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含砷(As )的有毒工业废水经如下图流程转化为粗Aa2O3。已知:亚砷酸钙微溶于水,砷酸钙难溶于水。
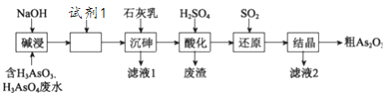
(1)加入试剂1的目的是:_________________________。
(2)“沉砷”是将砷元素转化为Ca5(AsO4)3OH 沉淀,发生的主要反应有:
A.Ca(OH)2(s) ![]() Ca2+(aq) + 2OH-(aq) ΔH <0
Ca2+(aq) + 2OH-(aq) ΔH <0
B.5Ca2+ + OH-+ 3AsO43-![]() Ca5(AsO4)3OH ΔH >0
Ca5(AsO4)3OH ΔH >0
研究表明:“沉砷”的最佳温度是85℃, 用化学平衡原理解释温度高于85℃后,随温度升高沉淀率下降的原因是________。
(3)“还原”过程中H3AsO4转化为H3AsO3,反应的化学方程式是________。
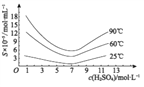
(4)通过对H3AsO3溶液进行_____(填操作名称),再过滤可制得粗As2O3。As2O3在不同温度和不同浓度硫酸中的溶解度(S)曲线如下图所示。为控制滤液2 中As2O3的浓度不高于6×10-5 mol·L-1 ,则“结晶”过程应控制的条件是______________________(例举一例回答)
(5)从绿色化学和综合利用的角度考虑,对滤液2 处理方法是:________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丙烯为原料合成抗炎药物D 和机体免疫增强制剂I的合成路线如下(部分反应条件和产物已经略去):
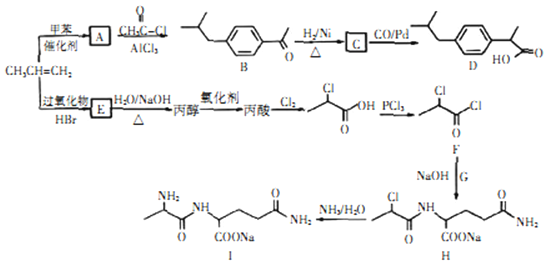
请回答下列问题:
(1)由丙烯生成E的反应类型为_______,E 的结构简式为_______。
(2)D 中的官能团名称为_______ 。
(3)化合物G 的化学式为C5H10O3N2,则其结构简式为_______。
(4)写出E生成丙醇的化学反应方程式_______ 。
(5)A的同分异构体中属于苯的同系物的共有_______种(不包含A),其中核磁共振氢谱有四组峰的是_______(写一种结构简式)。
(6)已知: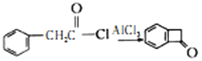 。结合上述流程的信息,设计由
。结合上述流程的信息,设计由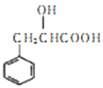 制备
制备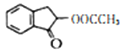 的合成路线_______________。
的合成路线_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com