
对于反应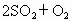

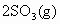 下列判断正确的是
下列判断正确的是
[ ]
A.2体积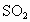 和足量
和足量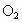 反应,必定生成2体积
反应,必定生成2体积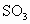
B.其他条件不变,增大压强,会使平衡向右移动
C.平衡时,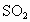 消耗速率必定等于
消耗速率必定等于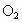 生成速率的两倍
生成速率的两倍
D.平衡时,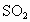 的浓度必定等于
的浓度必定等于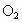 的浓度的两倍
的浓度的两倍
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ | B、加水稀释后,溶液中c(NH4+)?c(OH-)变大 | C、用HNO3溶液完全中和后,溶液不显中性 | D、其溶液的pH=13 |
查看答案和解析>>
科目:高中化学 来源:2014届河北省高一3月月考化学试卷(解析版) 题型:选择题
对于反应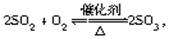 下列判断正确的是( )
下列判断正确的是( )
A.2 mol SO2和足量的O2反应,必生成2 mol SO3
B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2
C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍
D.平衡时SO2的浓度必为O2浓度的2倍
查看答案和解析>>
科目:高中化学 来源:2011-2012学年河北省保定三中高一3月月考化学试卷(带解析) 题型:单选题
对于反应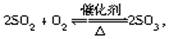 下列判断正确的是( )
下列判断正确的是( )
| A.2 mol SO2和足量的O2反应,必生成2 mol SO3 |
| B.平衡时SO2、O2、SO3的分子数之比为2∶1∶2 |
| C.平衡时SO2的消耗速率必定等于O2的生成速率的2倍 |
| D.平衡时SO2的浓度必为O2浓度的2倍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com