
| A����֪t��ʱ��MgCO3��Ksp=4��10-6����MgCO3������Һ�к�Mg2+��ĿΪ2��10-3 NA |
| B��һ�������£�2.3g��Na��ȫ��O2��Ӧ����3.6g����ʱʧȥ�ĵ�����һ��Ϊ0.1NA |
| C��CO2ͨ��Na2O2ʹ������bgʱ����Ӧ��ת�Ƶĵ�����ΪbNA/44 |
| D��1mol�����һ�֧��������������������̼ԭ��������Ϊ5NA |
| m |
| M |
| 4��10-6 |
| 23g |
| 23g/mol |
| m |
| 28 |


 �ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
�ִʾ�ƪ��ͬ�����Ĵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
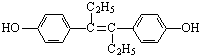
| A����ϩ�Ʒӵķ���ʽΪC18H20O2 |
| B����ϩ�Ʒӷ�����һ����16��̼ԭ�ӹ�ƽ�� |
| C����ϩ�Ʒ�Ϊ�����廯���� |
| D����ϩ�Ʒӿɷ����ӳɡ�ȡ�����������Ӿۡ�������������Ӧ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����Ԫ�ص����ֲ�ͬ�� |
| B��������Ԫ�� |
| C����������ͬ�������� |
| D����������ͬλ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
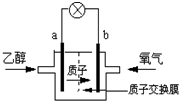 һ�������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32��������ܷ�ӦΪ��C2H5OH+3O2=2CO2+3H2O�����ʾ��ͼ��ͼ����������ֵ�ص�˵����ȷ���ǣ�������
һ�������Ҵ�����û������������ܼ����ȼ״����Ч�ʸ߳�32��������ܷ�ӦΪ��C2H5OH+3O2=2CO2+3H2O�����ʾ��ͼ��ͼ����������ֵ�ص�˵����ȷ���ǣ�������| A��b��Ϊ��صĸ��� |
| B����ÿ��������������Ϊq���أ���1mol�Ҵ�����������12NAq���صĵ��� |
| C����ع���ʱ������a���ص��߾������ٵ�b�� |
| D����������ĵ缫��ӦΪ��O2+4e-+2H2O=4OH- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��pH���ݣ��ۣ��ܣ��ڣ��٣��� |
| B��c��A2-�����ݣ��ڣ��ܣ��٣��ޣ��� |
| C����Һ��c��H+�����ޣ��٣��ܣ��ڣ��ۣ��� |
| D��c��H2A�����ޣ��ܣ��٣��ڣ��ݣ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ӿ�����һ���������Ӽ�����һ�����ڹ��ۼ� |
| B������״̬���ܵ���Ļ�����һ�������Ӽ���������ǽ���Ԫ���γɵĻ�����һ�������ӻ����� |
| C��NCl3���������е�ԭ�Ӿ�Ϊ8�����ȶ��ṹ |
| D��NaHSO4���������������ӵĸ�������1��2�����ۻ�ʱ�ƻ��������Ӽ����ۼ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��2Al3++3SO42-+3Ba2++6OH-=2Al��OH��3��+3BaSO4�� |
| B��A13++2SO42-+2Ba2++3OH-=A1��0H��3��+2BaSO4�� |
| C��2Ba2++4OH-+Al3++2SO42-=2BaSO4��+AlO2-+2H2O |
| D��Ba2++3OH-+Al3++SO42-=BaSO4��+A1��0H��3�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��ʵ������ȡ������Ϊ�˼ӿ췴Ӧ���ʣ�����ϡH2SO4�еμ�����Cu��NO3��2��Һ |
| B��Ϊ������¯ˮ���е�CaSO4�������ñ���Na2CO3��Һ���ݣ��ټ��������ܽ� |
| C����֪NaOH��aq��+HCl��aq���TNaCl��aq��+H2O��l����H=-57.3kJ?mol-1��ˮ������Ȼ�ѧ����ʽΪ��H2O��l��?H+��aq��+OH-��aq����H=+57.3 kJ?mol-1 |
| D����������������ʴ�����ⸯʴ�ĸ�����Ӧ��Ϊ��Fe-2e-=Fe2+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com