

分析 I.(1)二氧化硫有毒,会导致酸雨,直接排放会污染空气,可以用于制备硫酸,二氧化硫属于酸性氧化物,能被碱性溶液吸收;
(2)检验SO2用品红溶液,品红溶液褪色说明含有SO2;检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2,由于SO2与石灰水反应也生成白色沉淀,会影响CO2的检验,故先检验SO2,后检验CO2,检验CO2之前用试剂SO2除去,但选择试剂不能吸收CO2,不能引入CO2,再经过品红溶液判断二氧化硫是否除尽;
Ⅱ.(1)过滤用到的玻璃仪器有:漏斗、烧杯、玻璃棒;
(2)加入氧化剂,将溶液中Fe2+氧化成Fe3+;
(3)FeO与硫酸反应生成硫酸亚铁,再滴入酸性高锰酸钾溶液,溶液紫色褪去,可以检验FeO存在.
解答 解:I.(1)二氧化硫有毒,会导致酸雨,直接排放会污染空气,可以用于制备硫酸,二氧化硫属于酸性氧化物,能被碱性物质吸收,所以可以用石灰水吸收,故选:bc;
(2)检验SO2用品红溶液,品红溶液褪色说明含有SO2;检验CO2用澄清石灰水,澄清石灰水变浑浊,说明含有CO2,由于SO2与石灰水反应也生成白色沉淀,会影响CO2的检验,故先检验SO2,后检验CO2,检验CO2之前用试剂SO2除去,但选择试剂不能吸收CO2,不能引入CO2,再经过品红溶液判断二氧化硫是否除尽.
①装置B的作用是除去SO2,防止影响CO2检验,选择试剂吸收二氧化硫,不能吸收CO2,不能引入CO2,
A.氢氧化钠溶液与二氧化碳、二氧化硫都反应,故A错误;
B.酸性高锰酸钾溶液氧化二氧化硫为硫酸,不吸收二氧化碳,故B正确;
C.盐酸不能和二氧化硫、二氧化碳反应,不能吸收二氧化硫,故C错误;
D.澄清石灰水和二氧化碳、二氧化硫都能反应,故D错误;
故答案为:B;
②装置C是检验二氧化硫是否被B吸收彻底的,
故答案为:检验二氧化硫是否被除尽;
③D中澄清石灰水的作用是:检验是否含CO2,
故答案为:检验是否含CO2;
Ⅱ.(1)过滤用到的玻璃仪器有:漏斗、烧杯、玻璃棒,
故答案为:漏斗、烧杯、玻璃棒;
(2)加入氧化剂,目的是将溶液中Fe2+氧化成Fe3+,
故答案为:将溶液中Fe2+氧化成Fe3+;
(3)FeO与硫酸反应生成硫酸亚铁,亚铁离子具有还原性,再滴入酸性高锰酸钾溶液,溶液紫色褪去,可以检验FeO存在,故选:AC.
点评 本题考查物质的制备与检验、对实验装置的理解、对操作与试剂的分析评价、尾气处理等,有利于培养学生的分析理解能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- | |
| B. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| C. | 加入氢氧化钠溶液,加热,产生使湿润的红色石蕊试纸变蓝的气体,一定有NH4+ | |
| D. | 加入氨水直至氨水过量,先产生白色沉淀,后沉淀消失,一定有Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )
温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)?PCl3(g)+Cl2(g)经过一段时间后达到平衡.反应过程中测定的部分数据如图.下列说法正确的是( )| A. | 反应在前50 s 的平均速率v(PCl3)=0.0032 mol•L-1•s-1 | |
| B. | 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11mol•L-1,则反应的△H<0 | |
| C. | 相同温度下,起始时向容器中充入2.0 mol PCl3和2.0mol Cl2,达到平衡时,PCl3 的转化率小于80% | |
| D. | 相同温度下,起始时向容器中充入1.0 mol PCl5、0.20 mol PCl3 和0.20 mol Cl2,反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
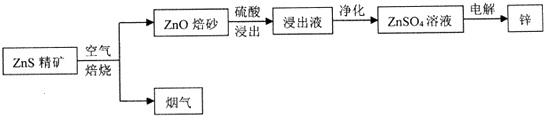
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
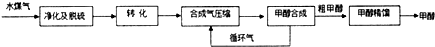
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol•L-1) | 0.2 | 0.1 | 0.4 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com