
���� ��֪����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1��
���ݸ�˹���ɣ��١�2-�ڡ�3�ɵã�2N2��g��+6H2O��l��?4NH3��g��+3O2��g�����ݴ˼���÷�Ӧ���ʱ��H��
��� �⣺��֪����N2��g��+3H2��g��?2NH3��g����H=-92.4kJ•mol-1��
��2H2��g��+O2��g���T2H2O��l����H=-571.6kJ•mol-1��
���ݸ�˹���ɢ١�2-�ڡ�3�ɵã�2N2��g��+6H2O��l��?4NH3��g��+3O2��g����H=��-92.4kJ•mol-1����2-��-571.6kJ•mol-1����3=+1530kJ•mol-1��
�ʴ�Ϊ��+1530kJ•mol-1��
���� ���⿼�鷴Ӧ�����ʱ��Ӧ�ã���Ŀ�ѶȲ����ݸ�˹������ȷ����Ŀ�귴ӦΪ���ؼ���ע�����ո�˹���ɵ����ݼ�Ӧ�÷���������������ѧ���ķ�����������ѧ����������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���ݱ�� | ����NaOH�����/mL | ��Һ��pH | |
| HX | HY | ||
| �� | 0 | 3 | 1 |
| �� | a | 7 | x |
| �� | 20.00 | ��7 | y |
| A�� | ����ͬ�¶��£�ͬŨ�ȵ���������Һ�ĵ���������HX��HY | |
| B�� | �ɱ������ݿɹ��Ƴ�Ka��HX����10-5 | |
| C�� | HY��HX��ϣ�c��H+��=c��X-��+c��Y-��+c��OH-�� | |
| D�� | ������Ӧ���HY��Һ�У�c��Na+����c��Y-����c��OH-����c��H+�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
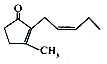
| A�� | ����ͪ������ˮ | |
| B�� | ����ͪ�к������ֹ����� | |
| C�� | ����ͪ������ˮ������KMnO4��Һ�����ӳɷ�Ӧ�������Ϊ��ɫ | |
| D�� | ����ͪ���������ͪ ��Ϊͬ���칹�� ��Ϊͬ���칹�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 16g | B�� | 17.6g | C�� | 17.8g | D�� | 18g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | 2FeCl3+Cu�T2FeCl2+CuCl2 | B�� | 2K+2H2O�T2KOH+H2�� | ||
| C�� | NaOH+HCl�TNaCl+H2O | D�� | C��s��+H2O��g���TCO��g��+H2��g�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | v��A��=2 mol•L-1•min-1 | B�� | v��B��=1.2 mol•L-1•s-1 | ||
| C�� | v��D��=0.4 mol•L-1•min-1 | D�� | v��C��=0.1 mol•L-1•s-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �÷�Һ©�������Ҵ������������Ļ���� | |
| B�� | ������ˮ��Ũ�������ڴ���Ƥ������ɫ����ƿ�� | |
| C�� | Ũ���ὦ��Ƥ����ʱ������ϡ����������Һ��ϴ | |
| D�� | ��������NaCl��ҺʱӦ�ò��������Ͻ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com