
【题目】某同学用NaHCO3和KHCO3组成的混合物进行实验,测得如下数据(盐酸的物质的量浓度相等)。下列分析推理正确的是
盐酸 | 50 mL | 50 mL | 50 mL |
m(混合物) | 9.2 g | 14.2 g | 27.6 g |
V(CO2)(标准状况) | 2.24 L | 3.36 L | 3.36 L |
A.盐酸的物质的量浓度为3.0 mol/L
B.当混合物质量为9.2 g时,50 mL盐酸恰好完全反应
C.混合物中NaHCO3、KHCO3的物质的量之比为1∶2
D.混合物中NaHCO3的质量分数为45.7 %
【答案】AD
【解析】
试题分析:由题意可知:9.2 g混合物与50 mL盐酸反应时盐酸过量,而27.6 g混合物与50 mL盐酸作用时盐酸不足。A.由反应H++HCO3-=CO2↑+H2O知,盐酸的物质的量为:n(HCl)=n(CO2)=![]() =0.15 mol,所以c(HCl)=0.15 mol÷0.05 L=3 mol/L,故A正确;B.生成3.36L二氧化碳需要混合物的质量为:
=0.15 mol,所以c(HCl)=0.15 mol÷0.05 L=3 mol/L,故A正确;B.生成3.36L二氧化碳需要混合物的质量为:![]() ×9.2g=13.8g<15.7g,所以9.2 g混合物与50 mL盐酸反应时盐酸过量,故B错误;C.设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x 和y,则有:x+y=0.1mol……①,84x+100y=9.2g……②,联立方程,解得:x=0.05 mol,y=0.05 mol,故n(NaHCO3):n (KHCO3)=0.05mol:0.05mol=1:1,故C错误;D.由C中计算可知,w(NaHCO3)=
×9.2g=13.8g<15.7g,所以9.2 g混合物与50 mL盐酸反应时盐酸过量,故B错误;C.设9.2 g混合物中NaHCO3、KHCO3的物质的量分别为x 和y,则有:x+y=0.1mol……①,84x+100y=9.2g……②,联立方程,解得:x=0.05 mol,y=0.05 mol,故n(NaHCO3):n (KHCO3)=0.05mol:0.05mol=1:1,故C错误;D.由C中计算可知,w(NaHCO3)=![]() ×100%=45.7%,故D正确;故选AD。
×100%=45.7%,故D正确;故选AD。


科目:高中化学 来源: 题型:
【题目】有机化合物反应如下图,据此回答下列问题:

(1)乙烯的结构式为: 。
(2)写出反应②④的化学方程式:
② ,反应类型: (1分);
④ ,反应类型: (1分)。
(3)实验室常用下列装置制取乙酸乙酯,请回答相关问题:

①饱和碳酸钠溶液的主要作用是 。
②若要把制得的乙酸乙酯分离出来,应采用的操作是 。
③进行该实验时,最好向试管甲中加入几块碎瓷片,其目的是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表示化学过程的化学式书写正确的是:
A.亚硫酸钠溶液显碱性:SO32-+2 H2O![]() H2SO3 +2 OH-
H2SO3 +2 OH-
B.氯化银投入水中后建立平衡:AgCl (s)![]() Ag+ (aq) + Cl-(aq)
Ag+ (aq) + Cl-(aq)
C.甲烷的燃烧热为890.3kJ·mol-1,表示甲烷燃烧热的热化学方程式为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
D.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) △H=-38.6 kJ·mol-1
2NH3(g) △H=-38.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上“固定”和利用CO2能有效地减轻“温室”效应,可用CO2生产燃料甲醇:
CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
CH3OH(g)+H2O(g) △H=-49.0 kJ·mol-1
(1)在相同温度和容积不变时,能说明该反应已达平衡状态的是 。
A.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
B.容器内压强保持不变
C.H2的消耗速率与CH3OH的消耗速率之比为3∶1
D.容器内的密度保持不变
(2)一定温度下,将6 mol CO2和8 mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线)。图中数据a(1,6)代表的意思是:在1 min时H2的物质的量是6 mol。
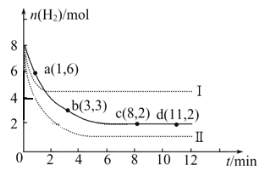
①a点正反应速率 逆反应速率(填“大于”、“等于”或“小于”),在1~3min内的平均反应速率v(H2)= 。
②仅改变某一实验条件时,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 ,曲线II对应的实验条件改变是 。
(3)甲醇可用于制作燃料电池,若电解质溶液为酸性,负极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某溶液中所含离子的鉴别,下列判断正确的是
A.加入BaCl2溶液,生成白色沉淀,加稀硝酸沉淀不消失,则原溶液中一定含有SO42-
B.加入NaOH溶液,生成的白色沉淀在空气中迅速变为灰绿色,最终变为红褐色,则原溶液中一定含有Fe2+。
C.用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色的火焰,则原溶液中一定不含有K+
D.加盐酸,生成的气体能使澄清石灰水变浑浊,则原溶液中一定含有CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42-、HCO3-等离子。当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是 ( )
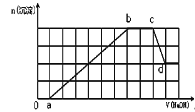
A.ab段发生的离子反应为:Al3++3OH-= Al(OH)3↓, Mg2++2OH-= Mg(OH)2↓
B.原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+
C.原溶液中含有的Fe3+和Al3+的物质的量之比为1:1
D.d点溶液中含有的溶质只有NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 最外层电子数大于4的一定是非金属元素
B. 元素周期表有18纵列,7横行,故有18个族,7个周期
C. 第ⅠA族就是碱金属
D. 某ⅡA族元素的原子序数为a,则和其同周期ⅢA的元素的原子序数可能为a+11
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com