

分析 (1)二氧化碳与氢气高温催化反应生成甲醇,由原子守恒可知还生成水;
(2)①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1;
②CO(g)+2H2(g)═CH3OH (g)△H2=-90.1kJ•mol-1;
由盖斯定律可知,①×2+②×2可得2CH4(g)+O2(g)═2CH3OH(g),以此计算△H;
(3)①由图可知,CO的转化率为50%,n(H2)/n(CO)=1.5,起始时均投入2mol CO,则投入氢气的3mol,则
CO(g)+2H2(g)?CH3OH(g),
开始 2 3 0
转化 1 2 1
平衡 1 1 1
则CO、H2、CH3OH的平衡浓度分别为0.5、0.5、0.5,以此计算K;
②“先拐先平数值大”知,T1℃先达到平衡状态;
③为提高CO的转化率,可改变条件是平衡正向移动,但不能增加CO的量;
(4)由图可知,I中发生CuFeS2+S═FeS2+CuS,II中发生CuS+2Cl-+Cu2+═S+2CuCl,过滤分离出S、FeS2,滤液中含+1价铜离子,通入空气发生氧化还原还原,以此来解答.
解答 解:(1)二氧化碳与氢气高温催化反应生成甲醇,由原子守恒可知还生成水,反应为CO2+3H2$→_{高温}^{催化剂}$CH3OH+H2O,
故答案为:CO2+3H2$→_{高温}^{催化剂}$CH3OH+H2O;
(2)①CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1=-35.4kJ•mol-1;
②CO(g)+2H2(g)═CH3OH (g)△H2=-90.1kJ•mol-1;
由盖斯定律可知,①×2+②×2可得2CH4(g)+O2(g)═2CH3OH(g),则△H=(-35.4kJ•mol-1)×2+(-90.1kJ•mol-1)×2=-251kJ•mol-1,
故答案为:-251;
(3)①由图可知,CO的转化率为50%,则
CO(g)+2H2(g)?CH3OH(g),
开始 2 3 0
转化 1 2 1
平衡 1 x-2 1
则CO、H2、CH3OH的平衡浓度分别为0.5、0.5、0.5,
则K=$\frac{0.5}{0.5×(0.5)^{2}}$=4,故答案为:4;
②“先拐先平数值大”知,T1℃先达到平衡状态,则T1>T2,故答案为:>;
③为提高CO的转化率,可改变条件是平衡正向移动,但不能增加CO的量,措施为增大压强或使生成的甲醇液化,从体系中分离出来,故答案为:增大压强;使生成的甲醇液化,从体系中分离出来;
(4)①CuFeS2+S═FeS2+CuS,CuFeS2中S的化合价为-2价,则S元素的化合价由-2价升高为-1价,S元素的化合价由0降低为-1价,该反应中转移e-,即生成1molFeS2转移1mol电子,则生成12g FeS2转移的电子数为$\frac{12g}{120g/mol}$×NA=0.1NA,故答案为:0.1NA;
②反应Ⅱ的离子方程式为CuS+2Cl-+Cu2+═S+2CuCl,故答案为:CuS+2Cl-+Cu2+═S+2CuCl;
③反应Ⅲ通入空气的目的是将反应Ⅱ生成的一价铜离子氧化成二价铜离子,故答案为:将反应Ⅱ生成的一价铜离子氧化成二价铜离子.
点评 本题考查较综合,涉及盖斯定律计算反应热、化学平衡计算及混合物分离提纯综合应用,注重高频考点的考查,把握物质的性质及相关反应原理为解答的关键,侧重分析与应用能力的综合考查,题目难度不大.


 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任.
铁是日常生活中广泛应用的金属.亚铁离子是血红蛋白的主要成分,它肩负着输送O2的重任. .一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.
.一定温度下,将2mol的W气体置于密闭容器中,保持压强不变,温度由T1升高到T2的过程中,气体逐渐变为无色.若保持T2,增大压强,气体又逐渐变为红棕色.气体的物质的量n随温度T变化的关系如图所示.温度在T2~T3之间,气体的平均相对分子质量是(保留1位小数)30.7.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)
,不考虑立体异构)是临床上使用广泛的.下图所示的其多条合成路线中的一条(反应试剂和反应条件均未标出)

 .
. .
.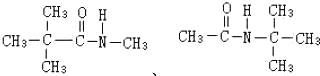 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 总反应速率由反应②决定 | |
| B. | 在(NH4)2S2O8消耗完后,溶液显蓝色 | |
| C. | 若能观察到蓝色出现,则起始时,n(Na2S2O3)=n[(NH4)2S2O8] | |
| D. | 0~t s内,v(S2O82-)=v(S2O32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Cl2 | C. | KClO3 | D. | HCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com