
【题目】某化学兴趣小组设计如下实验方案。将浓硫酸与铜片反应制备SO2并进行相关实验探究,实验装置如图所示。请回答下列问题:

(1)装置B的作用是________________。
(2)装置C中发生反应的离子方程式是_____________________________。
SO2在装置D中完全转化为酸式酸根离子的过程中,溶液颜色变化是________。
(3)已知酸性:HCl>H2SO3>HClO。向Na2SO3溶液中加入盐酸酸化的NaClO溶液时,证明NaClO不足时的试剂是________。
(4)请设计简单实验证明:室温下HSO3-的电离平衡常数Ka大于其水解平衡常数Kh。______________。
【答案】防倒吸(或安全瓶) SO2+Br2+2H2O═4H++SO42-+2Br- 有红色变为无色 盐酸和品红溶液 常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kh
【解析】
(1)A中发生Cu与浓硫酸的反应生成二氧化硫,B作安全瓶,可防止倒吸;
(2)C中二氧化硫与溴水反应生成硫酸和溴化氢,据此写出离子方程式;装置D中NaOH全部转化为NaHSO3时碱性降低;
(3)根据酸性:HCl>H2SO3>HclO,若NaClO不足,则剩余Na2SO3,先滴加盐酸反应生成SO2逸出,再滴加品红溶液不褪色;若NaClO过量,则剩余NaClO,先滴加盐酸反应生成HClO,HClO具有强氧化性,再滴加品红溶液褪色;
(4)根据电离显酸性,水解显碱性,则测定pH即可。
(1)铜片与浓硫酸在加热条件下,反应生成SO2,因为SO2易溶于水且能与溴水反应,容易产生倒吸,所以装置B的作用是:防止C中液体倒吸入A中。
故答案为:防倒吸(或安全瓶);
(2)装置C中盛有溴水,具有较强的氧化性,可以与SO2发生反应,反应的离子方程式为SO2+Br2+2H2O═4H++SO42-+2Br-;若NaOH全部转化为NaHSO3,溶液碱性降低,溶液由红色变为无色。
故答案为:SO2+Br2+2H2O═4H++SO42-+2Br-;溶液由红色变为无色;
(3)若NaClO不足,则剩余Na2SO3,先滴加盐酸反应生成SO2逸出,再滴加品红溶液不褪色;若NaClO过量,则剩余NaClO,先滴加盐酸反应生成HClO,HClO具有强氧化性,再滴加品红溶液褪色,因此可选用盐酸和品红溶液证明NaClO不足。
故答案为:盐酸和品红溶液;
(4)常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则溶液显酸性,HSO3-电离程度大于水解程度,即Ka>Kh;若pH>7,则其电离程度小于水解程度,即Ka>Kh。
故答案为:常温下,用pH试纸(或pH计)测定NaHSO3溶液的pH,若pH<7,则Ka>Kh。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)![]() 2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol 时间/min | n(N2) | n(H2) | n(NH3) |
0 | 1.0 | 1.2 | 0 |
2 | 0.9 | ||
4 | 0.75 | ||
6 | 0.3 |
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型锂-空气电池具有能量密度高的优点,可以用作新能源汽车的电源,其结构如图所示,其中固体电解质只允许Li+通过。下列说法不正确的是
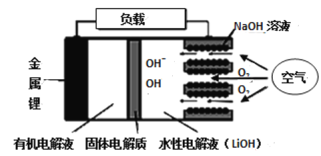
A. 放电时,负极反应式:Li-e- =Li+
B. 应用该电池电镀铜,阴极质量增加64 g,理论上将消耗标准状况下11.2 L O2
C. 放电时,随外电路中电子的转移,水性电解液中离子总数减少
D. Li+穿过固体电解质向正极移动而得到LiOH溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol A和2 mol B两种气体混合于2 L密闭容器中,发生反应3A(g)+B(g)![]() xC(g)+2D(g),2 min末反应达到平衡状态,生成0.8 mol D,并测得C的浓度为0.4 mol/L。由此推断:
xC(g)+2D(g),2 min末反应达到平衡状态,生成0.8 mol D,并测得C的浓度为0.4 mol/L。由此推断:
(1)x值等于__;
(2)A的转化率为__;
(3)B的平衡浓度为__mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将露置于空气中的某氢氧化钠固体样品溶于水,向所得溶液中逐滴加入稀盐酸至过量,生成的CO2(标准状况)与加入的盐酸的体积有如图所示的关系(不考虑CO2在水中的溶解)。下列说法不正确的是( )
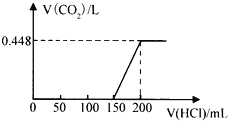
A. 滴加盐酸0→150mL段发生的反应依次为OH-+H+=H2O、CO32-+H+=HCO3-
B. 所用盐酸的物质的量浓度为0.4 molL﹣1
C. CO2体积不再改变时,溶液中的溶质为NaCl
D. 该样品中NaOH与Na2CO3物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素化合物在日常生活、化工生产和环境科学中有着重要的用途。
(1)生铁中含有一种铁碳化合物X(Fe3C)。X在足量的空气中高温煅烧,生成有磁性的固体Y,将Y溶于过量盐酸后溶液中大量存在的阳离子是______________。
(2)自然界中Cr主要以+3价和+6价形式存在。Cr2O72-中的Cr能引起细胞的突变,可以用亚硫酸钠在酸性条件下将Cr2O72-还原。写出反应的离子方程式:___________________________________________。
(3)当皮肤划破时可用FeCl3溶液应急止血,其主要作用是__________________。
(4)高铁酸钾(K2FeO4)是一种既能杀菌、消毒、又能絮凝净水的水处理剂。工业制备高铁酸钾的反应离子方程式Fe(OH)3+ C1O-+ OH-→ FeO42-+ C1-+ H2O(未配平),Fe(OH)3与 C1O-的计量数比为:__________,每生成1mol K2FeO4,转移的电子数是_________。
(5)合成氨及其相关工业中,部分物质间的转化关系如下:

反应IV属于___________反应类型,氮肥主要成分的化学式为_______________,V的化学反应方程式为_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的C-NaMO2电池是科学家正在研发的钠离子电池,据悉该电池可以将传统锂电池的续航能力提升7倍。该电池反应式为:NaMO2+nC![]() Na(1-x)MO2+NaxCn,下列正确的是
Na(1-x)MO2+NaxCn,下列正确的是

A. 充电时,左侧电极为阳极
B. 电解质可以选用无水乙醇
C. 放电时,负极电极反应时为:NaMO2-xe-=Na(1-x)MO2+xNa+
D. 充电时,阳极电极反应式为:nC+xNa-xe-=NaxCn
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在固定容积的密闭容器中,可逆反应A(g)+3B(g) ![]() 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则 ( )
A. 平衡不移动
B. 再达平衡时,n(A)∶n(B)∶n(C)仍为2∶2∶1
C. 再达平衡时,C的体积分数增大
D. 再达平衡时,正反应速率增大,逆反应速率减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com