
甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应制备甲醇。
Ⅰ:CH4(g)+H2O(g)===CO(g)+3H2(g) ΔH=+206.0 kJ·mol-1
Ⅱ:CO(g)+2H2(g)===CH3OH(g) ΔH=-129.0 kJ·mol-1
(1)CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为_______________。
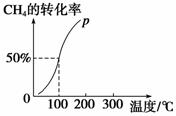 (2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
(2)将1.0 mol CH4和2.0 mol H2O(g)通入容积为100 L的反应室中,在一定条件下发生反应Ⅰ,测得在一定的压强下CH4的转化率与温度的关系如右图。
①假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平衡反应速率为____________________。
②100 ℃时反应Ⅰ的平衡常数为__________________。
(3)在压强为0.1 MPa、温度为300 ℃条件下,将a mol CO与3a mol H2的混合气体在催化剂作用下发生反应Ⅱ生成甲醇,平衡后将容器的容积压缩到原的1/2,其他条件不变,对平衡体系产生的影响是________(填字母序号)。
A.c(H2)减小
B.正反应速率加快,逆反应速率减慢
C.CH3OH的物质的量增加
D.重新平衡c(H2)/c(CH3OH)减小
E.平衡常数K增大
科目:高中化学 来源: 题型:
下列比较中,正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的NH4Cl和 NaOH溶液等体积混合后:
c(NH )>c(Cl)>c(Na)>c(OH)>c(H)
)>c(Cl)>c(Na)>c(OH)>c(H)
C.物质的量浓度相等的H2S和NaHS混合溶液中:
c(Na)+ c(H)=c(S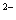 )+ c(HS)+ c(OH)
)+ c(HS)+ c(OH)
D.同物质的量浓度的下列溶液中, NH4Al(SO4)2、
NH4Al(SO4)2、 NH4Cl、
NH4Cl、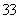 CH3COONH4、
CH3COONH4、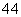 NH3·H2O;c(NH
NH3·H2O;c(NH )由大到小的顺序是:
)由大到小的顺序是: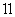 >
>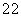 >
>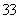 >
>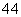
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各反应达到化学平衡后,加压或降温都能使化学平衡向逆反应方向移动的是
A. 2NO2  N2O4 (正反应为放热反应)
N2O4 (正反应为放热反应)
B. C(s)+ CO2  2CO (正反应为吸热反应)
2CO (正反应为吸热反应)
C. N2 + 3H2  2NH3 (正反应为放热反应)
2NH3 (正反应为放热反应)
D. H2S  H2 + S(s)(正反应为吸热反应)
H2 + S(s)(正反应为吸热反应)
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的容器内,发生反应2A(s)+3B(g)  2C(g)+D(g),起始时充入3 mol A和2.5 mol B混合气体;经过5 min生成0.5 mol D,下列说法正确的是( )
2C(g)+D(g),起始时充入3 mol A和2.5 mol B混合气体;经过5 min生成0.5 mol D,下列说法正确的是( )
A.若单位时间内生成的B和D的物质的量之比为3∶1,则体系处于平衡状态
B.C的平衡浓度为2 mol·L-1
C.B的平均消耗速率为0.3 mol·L-1·min-1
D.平衡后,增大压强,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是 ( )
①正常雨水的PH为7.0,酸雨的PH小于7.0。
②严格执行机动车尾气排放标准有利于防止大气污染
③使用二氧化硫和某些含硫化合物进行增白的食品会对人体健康产生损害
④使用氯气对自来水消毒过程中,生成的有机氯化物可能对人体有害
⑤食品厂产生的含丰富氮、磷营养素的废水可长期排向水库养鱼
A、①②③ B、①④⑤ C、②③④ D、③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
X+、Y+、Z2-是3种主族元素的离子,X+和Z2-具有相同的电子层结构,Y和Z处于同一周期,关于元素X、Y、Z的下列叙述中不正确的是( )
A.原子序数:X>Z>Y B.原子半径:Y>Z>X
C.离子半径:Z2->X+>Y+ D.一定能形成化合物X2Z
查看答案和解析>>
科目:高中化学 来源: 题型:
哈伯因发明了由氮气合成氨气的方法而获得1918年诺贝尔化学奖。现向一密闭容器中充入1 mol N2和3 mol H2,在一定条件下使该反应发生。下列有关说法正确的是( )
A.达到化学平衡时,N2将完全转化为NH3
B.达到化学平衡时,N2、H2和NH3的物质的量浓度一定相等
C.达到化学平衡时,N2、H2和NH3的物质的量浓度不再变化
D.达到化学平衡时,正反应和逆反应的速率都为零
查看答案和解析>>
科目:高中化学 来源: 题型:
在恒温下,容积为2L的密闭容器中加人1mol N2和X mol H2,发生如下反应:
N2(g)+3H2(g) 2NH3(g),50秒后达到平衡,测得反应放出的热量为18.4 kJ,
2NH3(g),50秒后达到平衡,测得反应放出的热量为18.4 kJ,
c(NH3)=0.2mol/L,总物质的量为3.6 mol.
(1)该反应的ΔH= kJ·mol-1
(2)该条件下此反应的化学平衡常数的表达式K=________________温度升高,则K值________。(填“变大”、“变小”或“不变”).
(3)起始时充入的H2的物质的量X为_____,从反应开始到平衡,用H2的浓度变化表示的反应速率为:_____________。
(4)若起始时加入N2 、H2 、NH3的物质的量分别为a、b、c,达到平衡时各组分的物质的量与上述平衡相同。
①若维持反应向正方向进行,则起始时c的取值范围是________________(3分).
②若c=2 mol,在相同条件下达到平衡时,该反应吸收的热量为____________ kJ.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com