
下列有关物质性质的应用错误的是
A.二氧化硅不与强酸反应,可用石英玻璃容器盛放氢氟酸
B.碳酸氢钠具有弱酸性,可用于食品发酵
C.次氯酸钠具有强氧化性,可用于配制消毒液
D.明矾能水解生成Al(OH)3胶体,可用作净水剂
科目:高中化学 来源:2014-2015河北省高一上学期第二次月考化学试卷(解析版) 题型:选择题
下列示意图与对应的反应情况正确的是
A.含0.01 mol KOH和0.01 mol Ca(OH)2的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
C.NaHSO4溶液中逐滴加入Ba(OH)2溶液
D.NaAlO2溶液中逐滴加入稀盐酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期期末理综化学试卷(解析版) 题型:填空题
【物质结构与性质】(15分)钙的化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为___________________.
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为_________.
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是_______________,构成丙烯腈元素中第一电离能最大的是__________.
(2)抗坏血酸钙的组成为Ca(C6H7O6)2?4H2O,其结构示意图如图1:

该物质中存在的化学键类型包括____________(填字母).
A.金属键 B.离子键 C.非极性共价键 D.配位键
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为____________.已知阿伏加德罗常数为NA,该晶体的密度为ρg·cm3,则晶胞中两Ca2+间的最近距离为______________cm.(用含NA、ρ的代数式表示)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:填空题
(12分)钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。
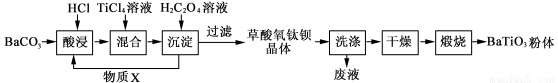
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式为 ;
可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三质量检测化学试卷(解析版) 题型:选择题
已知X、Y、Z、W、R是原子序数依次增大的短周期主族元素,X是周期表中原子半径最小的元素,Y元素的最高正价与最低负价绝对值相等,Z的核电荷数是Y的2倍,W最外层电子数是最内层电子数的3倍.下列说法正确的是
A.微粒半径:Z2+>W2->R-
B.对应氢化物的稳定性:W>R
C.W与X、W与Z形成的化合物晶体类型相同
D.Y的最高价氧化物对应的水化物是弱酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:填空题
[物质结构与性质]乙烯酮 (CH2=C=O)是一种重要的有机中间体,可由C2H2和O2的混合气体通过锌、钙、银的三种金属的氧化物(催化剂)反应得到。也可用CH3COOH在痕量(C2H5O)3P=O存在下加热脱H2O得到。
(1)Zn2+基态核外电子排布式为 。
(2)与H2O互为等电子体的一种阴离子为 ;乙烯酮分子中碳原子杂化轨道类型有 。
(3)CH3COOH的沸点比HCOOCH3的高,其主要原因是 。
(4)lmol(C2H5O)3P=O分子中含有的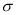 键的数目为 。
键的数目为 。
(5)Ag的氧化物的晶胞结构如图所示,
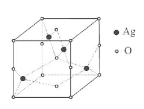
该氧化物的化学式为 .
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南京市、盐城市高三一模化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为1.0L的恒容密闭容器中,充入一定量的H2和SO2发生下列反应:
3H2(g)+SO2(g)  2H2O(g)+H2S(g)
2H2O(g)+H2S(g)
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
H2 | SO2 | H2 | SO2 | ||
容器I | 300 | 0.3 | 0.1 | / | 0.02 |
容器II | 300 | 0.6 | 0.2 | / | / |
容器III | 240 | 0.3 | 0.1 | / | 0.01 |
下列说法正确的是
A.该反应正反应为吸热反应
B.容器II达到平衡时SO2的转化率比容器I小
C.容器III达到平衡的时间比容器I短
D.240℃时,该反应的平衡常数为1.08×104L? mol-1
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省连云港等四市高三一模化学试卷(解析版) 题型:实验题
(15分)碘化钠是实验室中常见的分析试剂,常用于医疗和照相业。工业上通常用水合肼(N2H4·H2O,100℃以上分解)还原法制取碘化钠,工艺流程如下:
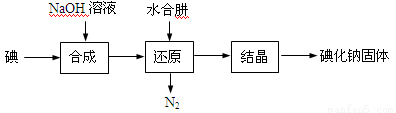
(1)合成过程的反应产物中含有IO3-,写出合成过程的离子方程式 。
(2)还原过程必须保持反应温度在60~70℃,这个温度既能保证反应的快速进行,又能 。工业上也可以用Na2S或Fe屑还原制备碘化钠,但水合肼还原法制得的产品纯度更高,原因是 。
(3)请补充完整检验还原液中是否含有IO3-的实验方案:取适量还原液, 。
实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液。
(4)测定产品中NaI含量的实验步骤如下:
a.称取4.000g样品、溶解,在250mL容量瓶中定容;
b.量取25.00mL待测液于锥形瓶中;
c.用0.1000mol·L-1AgNO3溶液滴定至终点,记录消耗AgNO3溶液的体积;
d.重复b、c操作2~3次,记录相关实验数据。
①滴定过程中,AgNO3溶液应放在 中;步骤d的目的是 。
②若用上述方法测定产品中的NaI含量偏低(忽略测定过程中的误差),其可能的原因是 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省肇庆市高三第一学期期末考试化学试卷(解析版) 题型:实验题
(16分)利用某地的闪锌矿(主要成分为ZnS,其杂质主要为铁、铜元素等)冶炼纯锌的传统工艺如下:

注:锌、铁、铜的沸点依次为1180K、2862K、1800K
(1)高温焙烧时,若氧气足量,则ZnS发生的化学反应方程式为 。
(2)方案1由锌熔体获得粗锌的的操作为 (填:“蒸馏”、“分馏”或“干馏”)。
(3)工业生产中方案2中固相2的成分为 ,液相1所含金属阳离子为:
(4)方案2中从液相1获取粗锌的过程中可用加入单质 除掉其他杂质;对比两种方案,方案2的优点是 。
(5)方案2的系列操作产生的废液可以制取绿矾。硫酸亚铁在不同温度下的溶解度和析出晶体的组成如下表所示:
温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 70 | 80 | 90 |
溶解度 | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 33.5 |
析出晶体 | FeSO4·7H2O | FeSO4·4H2O | FeSO4·H2O | ||||||
从上表数据可以得出的结论是:① ;② 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com