
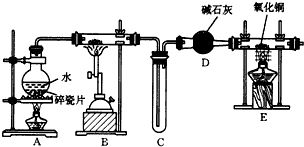
分析 (1)根据铁与水蒸气反应的条件是高温,水的状态是气体分析可知A装置的作用是造水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂;
(3)根据氢气还原氧化铜得到铜和水进行分析;
(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处; 氢气是可燃性气体混有空气会发生爆炸,需要验纯.
解答 解:(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是造水蒸气,B中是铁与水蒸气反应生成氢气和四氧化三铁,方程式为:3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2,
故答案为:制得水蒸气; 3Fe+4H2O(g)$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2;
(2)E是氢气还原氧化铜的实验,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,
故答案为:干燥氢氢(或除掉氢气中的水蒸气);
(3)氢气还原氧化铜得到铜和水即H2+CuO$\frac{\underline{\;\;△\;\;}}{\;}$Cu+H2O,所以硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成,
故答案为:硬质玻璃管中黑色固体变为红色,硬质玻璃管右端管壁有液滴生成;
(4)若先点燃B处,铁会与氧气先发生反应,所以须先点燃A处;氢气是可燃性气体混有空气会发生爆炸,所以点燃E处酒精灯之前应进行的操作是验证氢气的纯度,方法是:收集一试管气体,将试管口靠近酒精灯火焰,弱发出噗的声音,说明气体纯净;若发生尖锐爆鸣声,说明气体不纯,
故答案为:A;收集H2,并检验其纯度.
点评 本题考查了铁与水蒸气反应方程式的书写,利用氢气还原氧化铜这个实验对产物氢气进行检验,考查了实验操作中的注意事项,题目较简单.


科目:高中化学 来源: 题型:解答题
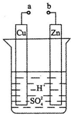 原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:
原电池是化学对人类的一项重大贡献.某兴趣小组为研究原电池原理,设计如图装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定量的Na与O2完全反应生成1mol产物时,转移电子数为2NA | |
| B. | 23g乙醇与足量金属钠完全反应时,可生成5.6L氢气 | |
| C. | 1molHCl气体与1molNH3完全反应时,可生成NA个NH4Cl分子 | |
| D. | 若1molCH4与1molCl2光照下充分反应,则生成的一氯甲烷分子的数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Cu2+、Fe3+、Al3+、K+ |
| 阴离子 | Cl-、CO32-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 )是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )
)是生活中常用食品添加剂-味精.在100℃以上使用味精,谷氨酸钠会转变为对人体有害的物质.下列有关味精的说法中正确的是( )| A. | 化学式为C5H9NO4Na | |
| B. | 味精难溶于水 | |
| C. | 只能和盐酸反应,不能和氢氧化钠溶液反应 | |
| D. | 炒菜时味精不宜早放 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极附近的 SO42-离子浓度逐渐增大 | |
| B. | 电子通过导线由铜片流向锌片 | |
| C. | 溶液的pH逐渐变小 | |
| D. | 铜片上有H2逸出 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com