
| A. | 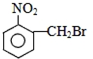 | B. | 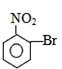 | C. | 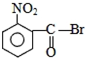 | D. | 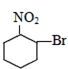 |
分析 含溴化合物中的溴原子,在适当条件下都能被羟基(-OH)取代,所得产物能跟NaHCO3溶液反应,说明水解后生成的官能团具有酸性,且酸性比H2CO3强,以此解答该题.
解答 解:A.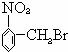 水解生成
水解生成 ,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故A错误;
,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故A错误;
B. 水解生成
水解生成 ,酚羟基比碳酸弱,不能与碳酸氢钠反应,故B错误;
,酚羟基比碳酸弱,不能与碳酸氢钠反应,故B错误;
C.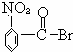 水解生成
水解生成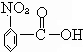 ,酸性比碳酸强,可与碳酸氢钠反应,故C正确;
,酸性比碳酸强,可与碳酸氢钠反应,故C正确;
D. 水解生成
水解生成 ,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故D错误.
,为醇类物质,不具有酸性,不能与碳酸氢钠反应,故D错误.
故选C.
点评 本题考查有机物的结构和性质,题目难度不大,注意能与碳酸氢钠反应的物质的酸性必须比碳酸强,注意有机物的结构,特别是官能团的结构和性质,把握有机物的转化.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:选择题
| A. | AgCl 在同浓度的 CaCl2和 NaCl 溶液中的溶解度相同 | |
| B. | 0.1 mol?L-1 的 Na2S 溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH=4.5 的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
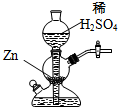
| A. | 将稀硫酸改为浓硫酸 | B. | 向稀硫酸中加入少量CuSO4固体 | ||
| C. | 向稀硫酸中加入AgNO3溶液 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、H+、NO3-、SiO32- | B. | Mg2+、Fe3+、SO42-、SCN- | ||
| C. | Na+、AlO2-、NO3-、OH- | D. | Na+、NH4+、NO3-、OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.
周期表中前四周期中的六种元素A、B、C、D、E、F原子序数依次增大,其中F为过渡元素,已知A原子2p轨道有3个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体熔点在同周期形成的单质中是最高的;F2+核外各电子层电子均已充满.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可以用米汤检验加碘食盐中的碘酸钾(KIO3) | |
| B. | 鱼、肉、虾等食品用福尔马林防腐保鲜 | |
| C. | 利用葡萄糖和银氨溶液,可在玻璃上镀银 | |
| D. | 缺钠会产生贫血,常在酱油中补钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com