
| A、滴定管用水洗后,未用标准溶液润洗就装入标准溶液 |
| B、锥形瓶盛待测液前,用待测液润洗 |
| C、读数时,滴定前仰视,滴定后俯视 |
| D、滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液 |


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定前滴定管中有气泡,滴定后消失 |
| B、碱式滴定管量取NaOH溶液时,未进行润洗操作 |
| C、滴定时达到滴定终点时俯视读数 |
| D、锥形瓶取用NaOH待测液前加少量水洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
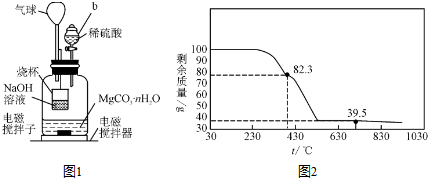
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2H2(g)+O2(g)→2H2O(l)+14.29 KJ |
| B、H2(g)+O2(g)→H2O(l)+285.8 KJ |
| C、2H2+O2→2H2O+571.6 KJ |
| D、2H2(g)+O2(g)→2H2O(l)-571.6 KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热化学方程式未注明温度和压强时,△H表示标准状况下的数据 |
| B、书写热化学方程式时,各反应物和生成物必须标注其聚集状态 |
| C、同一化学反应,化学计量数不同,△H不同,化学计量数相同而状态不同,△H也不相同 |
| D、化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、正四面体烷的二氯取代产物有2种 |
| B、正四面体烷与乙烯基乙炔互为同分异构体 |
| C、苯与环辛四烯互为同系物 |
| D、等质量的苯与环辛四烯完全燃烧消耗氧气量不相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com