
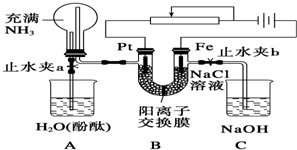
分析 (1)用Fe作阳极、Pt作阴极电解饱和食盐水时,阴极上水得电子生成氢气和氢氧根离子,阳极上铁失电子发生氧化反应;
(2)①生成的氢气通过导管进入A中烧瓶,烧瓶内压强增大,打开止水夹a,氨气进入A中烧杯,烧瓶内压强急剧减小,水进入烧瓶中;
②烧瓶中液面上升,当高于左侧导管时,因为压强增大会导致液面下降;
(3)关闭a打开b时,左侧生成的氢气导致U型管内液面左低右高,生成的亚铁离子进入C中生成氢氧化亚铁沉淀;氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀.
解答 解:(1)用Fe作阳极、Pt作阴极电解饱和食盐水时,阴极上水得电子生成氢气和氢氧根离子,阳极上铁失电子发生氧化反应,所以阴极、阳极反应式分别为,
故答案为:2H2O+2e-═H2↑+2OH-(或2H++2e-═H2↑);Fe-2e-═Fe2+;
(2)①生成的氢气通过导管进入A中烧瓶,烧瓶内压强增大,打开止水夹a,氨气进入A中烧杯,烧瓶内压强急剧减小,水进入烧瓶中,无色酚酞试液遇碱变红色,所以看到的现象是A烧杯中水倒吸产生红色喷泉,
故答案为:A烧杯中的水倒吸并产生红色喷泉;
②烧瓶中液面上升,当高于左侧导管时,因为压强增大会导致液面下降,最终与导管相平,
故答案为:上升到高于左侧导管一定程度后又逐渐下落至与导管相平;
(3)关闭a打开b时,左侧生成的氢气导致U型管内液面左低右高,生成的亚铁离子进入C中生成氢氧化亚铁沉淀,离子方程式为Fe2++2OH-═Fe(OH)2↓;氢氧化亚铁不稳定,易被氧气氧化生成红褐色氢氧化铁沉淀,所以C中现象为白色沉淀迅速变为灰绿色,最后变为红褐色,
故答案为:Fe2++2OH-═Fe(OH)2↓;白色沉淀迅速变为灰绿色,最后变为红褐色.
点评 本题考查电解原理,为高频考点,涉及电解、喷泉实验、氢氧化亚铁的制备及其性质等知识点,明确各个电极上发生的反应是解本题关键,注意:较活泼金属作阳极时,阳极上金属失电子而不是电解质溶液中阴离子失电子,为易错点.


 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 2 | B. | 3 | C. | 4 | D. | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知2C(s)+2O2(g)═2CO2(g)△H1;2C(s)+O2(g)═2CO(g)△H2,则△H1>△H2 | |
| B. | 已知C(石墨,s)═C(金刚石,s)△H>0,则金刚石比石墨稳定 | |
| C. | 在稀溶液中:H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ/mol,若将含0.6mol H2SO4的稀硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3kJ | |
| D. | 需要加热的反应说明它是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
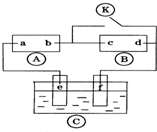 图中
图中 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽.接通电路后发现
为电镀槽.接通电路后发现 上的c点显红色.为实现铁上镀锌,接通
上的c点显红色.为实现铁上镀锌,接通 后,下列叙述正确的是( )
后,下列叙述正确的是( )| A. | a为直流电源的负极 | B. | d极发生的反应为2H++2e-═H2↑ | ||
| C. | e极发生氧化反应 | D. | f电极为锌板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每消耗1 mol C3H8可以向外电路提供12 mol e- | |
| B. | 负极通入C3H8,发生还原反应 | |
| C. | 正极通入氧气和CO2,正极反应式是:O2+2CO2+4e-═2CO32- | |
| D. | CO32-移向电池的正极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 非金属氧化物均为酸性氧化物 | |
| B. | 冰醋酸、一水合氨、次氯酸都是弱电解质 | |
| C. | 盐酸、硫酸、硝酸都是强电解质 | |
| D. | 液氨、液氯、液体氯化氢都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 一定条件下,将0.5 mol N2和1.5 molH2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | 在101kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为:2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ/mol | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com