
几种短周期元素的原子半径及主要化合价如下表:
元素代号 | X | Y | Z | M | N | R | Q | |
原子半径(×10-10 m) | 1.86 | 0.99 | 1.43 | 1.60 | 1.02 | 0.75 | 0.74 | |
主要化合价 | 最高正价 | +1 | +7 | +3 | +2 | +6 | +5 | —— |
最低负价 | —— | -1 | —— | —— | -2 | -3 | -2 | |
下列说法正确的是
A.气态氢化物的稳定性:N > Y
B.M(OH)2的碱性比XOH的碱性强
C.元素X和Q形成的化合物中可能含有共价键
D.X、Z、R的最高价氧化物对应的水化物之间可两两相互反应
 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源:2015届广东省湛江市高三第一次月考理综化学试卷(解析版) 题型:实验题
(16分)Fe2+和I-是两种常见的还原性离子。
(1)向FeSO4溶液中滴加氯水,溶液由浅绿色变成黄色,反应的离子方程式为 ;向KI溶液中滴加氯水,溶液由无色变成黄色,反应的离子方程式: 。
(2)请以FeSO4溶液、KI溶液、氯水为试剂验证I-的还原性强于Fe2+。设计实验方案,补充完成实验步骤、预期现象和结论。其他限选试剂:3 mol·L-1 H2SO4、0.01 mol·L-1 KMnO4、20% KSCN、3%H2O2、淀粉溶液、紫色石蕊溶液。
实验步骤 | 预期现象与结论 |
步骤1:取2mLFeSO4溶液和2mLKI溶液混合于试管中,再滴加1~2滴氯水。 |
; |
步骤2: ____________________________________ ____________________________________。 |
|
(3)利用(2)提供的试剂证明碘与铁的化合物中铁显+2价,实验操作和现象是:取少量样品溶于水, 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省海珠等四区高三联考理综化学试卷(解析版) 题型:选择题
短周期元素R、T、Q、W在元素周期表中的相对位置如下图所示,其中Q单质可制成半导体材料。下列判断正确的是
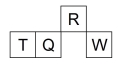
A.W形成的离子半径大于T形成的离子半径
B.W的单质在过量氧气中燃烧生成WO3
C.最高价氧化物的水化物的酸性:R<Q
D.T是地壳中含量最多的金属元素,其单质的化学性质较活泼
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)铜及其化合物在生产和生活实际中应用广泛。
Ⅰ.某学习小组对粗铜提纯(电解精炼)后的阳极泥(主要成分为银、金)进行如下实验。
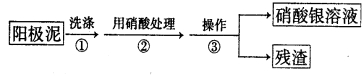
(1)操作③所需的仪器有:烧杯、 。
(2)稀硝酸处理阳极泥得到硝酸银稀溶液,写出该步反应的化学方程式_____ _。
(3)为了回收金,他们查阅了有关资料如下表:
编号 | 常温下反应 | 化学平衡常数 |
反应1 | Au + 6HNO3 | <10?5 |
反应2 | Au3+ + Cl? | >105 |
从资料中可知,常温下金很难与硝酸反应,但却可溶于王水(浓硝酸与浓盐酸体积比为1∶3的混合物)。请你运用化学平衡移动原理,简要说明金能溶于王水的原因: 。
Ⅱ.实验室用铜制备CuSO4溶液有多种方案,某实验小组给出了以下三种方案:
请回答有关问题:

(4)甲方案:将6.4g铜丝放到90 mL 1.5 mol·L-1的稀硫酸中,控温在50℃。加入40 mL 10%的H2O2,反应0.5小时,升温到60℃,持续反应1小时后,经一系列操作,得CuSO4·5H2O 20.0 g【已知有关摩尔质量:M(Cu)=64 g/mol, M(CuSO4·5H2O) =250 g/mol】。
①反应时温度控制在50℃~60℃,不宜过高的原因是 ;
②本实验CuSO4·5H2O的产率为 。
(5)乙方案:将空气或氧气直接通入到铜粉与稀硫酸的混合物中,发现在常温下几乎不反应。向反应液中加少量FeSO4,即发生反应,生成硫酸铜。反应完全后,加物质A调节pH至4 ,然后过滤、浓缩、结晶。
①物质A可选用以下的 (填序号);
A.CaO B.NaOH C.CuCO3 D.Cu2(OH)2CO3 E.Fe2(SO4)3
②反应中加入少量FeSO4可加速铜的氧化,FeSO4的作用是 ;
(6)丙方案:为了节约原料,硫酸和硝酸的物质的量之比最佳为,n(H2SO4):n(HNO3)= 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:选择题
下列各组离子中,在强酸性的透明溶液中能大量共存的是
A.Cu2+、K+、NO3-、SO42- B.Na+、Ba2+、NO3ˉ、CO32ˉ
C.K+、Na+、Iˉ、NO3ˉ D.Al3+、Na+、SO42-、HCO3ˉ
查看答案和解析>>
科目:高中化学 来源:2015届广东省惠州市高三第二次调研考试化学试卷(解析版) 题型:选择题
下列各溶液中,微粒的物质的量浓度关系正确的是
A. 常温下,将pH=2的盐酸和pH=12的氨水等体积混合: c(NH4+)>c(Cl-)> c(OH-)>c(H+)
B. 0.1mol·L-1 Na2CO3溶液:c(Na+)=c(HCO3-)+2c(CO32-)+2c(H2CO3)
C. 0.1mol·L-1 NH4Cl溶液:c(NH4+)=c( Cl-)
D. 向醋酸钠溶液加适量醋酸,得到的混合溶液:c(Na+)+ c(H+)=c(CH3COO-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三9月第二次月考化学试卷(解析版) 题型:选择题
莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是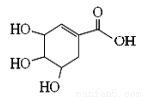
A.分子式为C7H6O5 B.分子中含有两种官能团
C.可发生加成和取代反应 D.分子中有7个碳原子共平面
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
下列实验现象预测正确的是
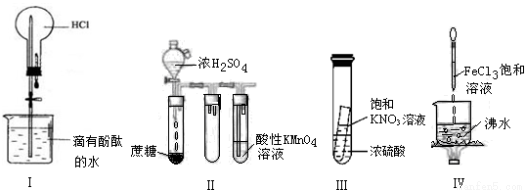
A.实验I:打开止水夹,烧瓶内出现红色喷泉
B.实验II:酸性KMnO4溶液中出现气泡,颜色无明显变化
C.实验III:静置一段时间,小试管内有晶体析出
D.实验IV:烧杯中液体变为红褐色后,继续加热煮沸,会出现浑浊
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com