
下列表示对应化学反应的离子方程式正确的是( )
|
| A. | 将过量SO2通入少量氨水中:SO2+2NH3•H2O═2NH4++SO32﹣ |
|
| B. | 实验室用Cu和稀HNO3反应制取少量NO气体:Cu+4H++NO3﹣═Cu2++NO↑+2H2O |
|
| C. | NaHSO4溶液与Ba(OH)2溶液反应至中性:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O |
|
| D. | KIO3与KI在酸性溶液中反应:5I﹣+IO3﹣+3H2O═3I2+6OH﹣ |
| 离子方程式的书写.. | |
| 专题: | 离子反应专题. |
| 分析: | A、过量SO2通入少量氨水,生成亚硫酸氢盐; B、得失电子不守恒,导致电荷不守恒; C、溶液反应至中性,说明氢离子和氢氧根离子的物质的量相等,所以硫酸根离子过量; D、酸性溶液中不存在氢氧根离子. |
| 解答: | 解:A、过量SO2通入少量氨水,生成亚硫酸氢盐,所以正确的离子反应方程式为:SO2+NH3•H2O═NH4++HSO3﹣,故A错误; B、得失电子不守恒,导致电荷不守恒,所以正确的离子反应方程式为3Cu+8H++2NO3﹣═3Cu2++2NO↑+4H2O,故B错误; C、溶液反应至中性,说明氢离子和氢氧根离子的物质的量相等,所以硫酸根离子过量,正确的离子反应方程式为:2H++SO42﹣+Ba2++2OH﹣═BaSO4↓+2H2O,故C正确; D、酸性溶液中不存在氢氧根离子,正确的离子方程式为:5I﹣+IO3﹣+6H+═3I2+3H2O,故D错误; 故选C. |
| 点评: | 本题考查离子方程式的书写,题目难度不大,注意从化学式、离子符号、电荷守恒以及是否符合反应实际的角度分析. |


 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案科目:高中化学 来源: 题型:
将食盐晶体与浓磷酸共热可得磷酸二氢钠与氯化氢气体;在磷酸二氢钠溶液中通入氯化氢气体又可得磷酸与氯化钠。上述两反应是否矛盾?若不矛盾,试以平衡移动原理解释。
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年世界环境日中国主题为“同呼吸·共奋斗”,其中防治PM2.5是重点。PM2.5是指大气中直径小于或等于2.5微米的颗粒物,是雾霾天气的主要原因,它主要来自化石燃料的燃烧,下列与PM2.5相关的说法不正确的是 ( )
A.大力发展电动车,减少燃油汽车的尾气排放量
B.开发利用各种新能源,减少对化石燃料的依赖
C.吸烟也会造成室内PM2.5污染
D.PM2.5含有的铅、镉、铬、钒、砷等对人体有害的元素均是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
“温室效应”是哥奉哈根世界气候变化大会研究的环境问题之一。CO2气体在大气层中具有吸热和隔热的功能,是主要的温室气体。
(1)下列措施中,有利于降低大气中CO2浓度的是 (填字母编号)。
a.采用节能技术,减少化石燃料的用量
b.鼓励乘坐公交车出行,倡导“低碳”生活
c.利崩太阳能、风能等新型能源替代化石燃料 ·
(2)CH4是另一种主要的温室气体,l克甲烷完全燃烧生成液态水和二氧化碳,放出55.64 kJ的热量,写出甲烷的燃烧热的热化学方程式 。
(3)酸阿的形成主要是由废气中的SOx和NOx造成的。通过SO2和Br2、H2O的定量反应在电解池中产生的电流变化,可以准确测定空气中SO2的含量。该反应的化学方程式为 。
(4)某硫酸工厂以黄铁矿为原料生产硫酸。 第一阶段燃烧黄铁矿的化学方程式为4FeS2+11O2 2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g)
2Fe2O3+8SO2;第二阶段的反应原理是2SO2(g)+O2(g) 2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
2SO3(g),其生产设备的名称为接触室;在生产过程中某一时刻取样分析:SO2、O2、SO3的浓度分别为2mol·L-1、2mol·L-1、3mol·L-1,当反应达到平衡时,可能存在的数据是 (填字母编号)
a. SO2为5mol·L-1,O2为3.5mol·L-1 b. SO2为3mol·L-1
c. SO2、SO3均为2.5mol·L-1 d. SO3为5mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是( )
|
| A. | Cu溶于稀硝酸:Cu+2H++NO3﹣=Cu2++NO2↑+H2O |
|
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO2﹣+2H2O=Al(OH)3↓+HCO3﹣ |
|
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH﹣=Fe(OH)2↓ |
|
| D. | 用CuCl2溶液做导电性实验,灯泡发光:CuCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有H+、Na+、NH4+、Mg2+、Fe3+、Al3+、SO42﹣、HCO3﹣等离子.当向该溶液中加入一定物质的量浓度的NaOH溶液时,发现生成沉淀物质的量随NaOH溶液的体积变化如图所示,下列说法正确的是
( )
|
| A. | ab段发生的离子反应为:Al3++3OH﹣=Al(OH)3↓,Mg2++2OH﹣=Mg(OH)2↓ |
|
| B. | 原溶液中含有的阳离子必定有H+、NH4+、Al3+、Mg2+ |
|
| C. | 原溶液中含有的Fe3+和Al3+的物质的量之比为1:1 |
|
| D. | d点溶液中含有的溶质只有NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某校化学实验兴趣小组在“探究卤素单质的氧化性”的系列实验中发现:在足量的氯化亚铁溶液中,加入1~2滴溴水,振荡后溶液呈黄色.
(1)提出问题:Fe3+、Br2谁的氧化性更强?
(2)猜想:
①甲同学认为氧化性:Fe3+>Br2,故上述实验现象不是发生氧化还原反应所致,则溶液呈黄色是含 (填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+,故上述现象是发生氧化还原反应所致,则溶液呈黄色是含 所致.
(3)设计实验并验证:
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点是正确的.
供选用的试剂:a、酚酞试液 b、CCl4 c、无水酒精 d、KSCN溶液.
请你在下表中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
| 选用试剂 | 实验现象 | |
| 方案1 |
|
|
| 方案2 |
|
|
(4)结论:氧化性:Br2>Fe3+.故在足量的氯化亚铁溶液中,加入1~2滴溴水,溶液呈黄色所发生的离子反应方程式为: .
(5)实验后的思考:
①根据上述实验推测,若在溴化亚铁溶液中通入氯气,首先氧化的离子是 (填离子符号).
②在100mLFeBr2溶液中通入2.24LCl2(标准状况),溶液中有的Br﹣被氧化成单质Br2,则原FeBr2溶液的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮:2OH-+2NO2=== +NO↑+H2O
+NO↑+H2O
B.碳酸氢钠溶液与过量的澄清石灰水反应: +Ca2++2OH-===CaCO3↓+
+Ca2++2OH-===CaCO3↓+ +2H2O
+2H2O
C.浓盐酸酸化的KMnO4溶液与H2O2反应: +6H++5H2O2===2Mn2++5O2↑+8H2O
+6H++5H2O2===2Mn2++5O2↑+8H2O
D.硫酸氢钠溶液与足量氢氧化钡溶液混合:H++ +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关金属及其化合物的说法中正确的是
A.铝和氢氧化钠溶液反应生成Al(OH)3和H2O
B.钠在空气中燃烧生成淡黄色的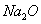
C.铁在高温下与水蒸气反应生成Fe2O3和H2
D.用碳酸钠和氢氧化钙反应制NaOH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com