

分析 根据题中各物质转化关系,红热的M与N的浓溶液反应生成混合气体,应为碳与浓硝酸或浓硫酸的反应,A与水生成气体和溶液B,气体与石灰水生成气体D,溶液B与过量C也生成气体D,C为常见金属,则M为碳,N为浓硝酸,A为CO2和NO2的混合气体,溶液B为硝酸,A与水反应得到的气体为NO和CO2的混合气体,通过石灰水后得气体D为NO,溶液B与过量C得E,E与过量B反应得F,则金属C有可变化合价,所以C为铁,E为硝酸亚铁,白色沉淀与硝酸反应得气体G为CO2,H为常见金属,CO2与H反应得M,则H为Mg,白色固体为MgO,据此答题.
解答 解:根据题中各物质转化关系,红热的M与N的浓溶液反应生成混合气体,应为碳与浓硝酸或浓硫酸的反应,A与水生成气体和溶液B,气体与石灰水生成气体D,溶液B与过量C也生成气体D,C为常见金属,则M为碳,N为浓硝酸,A为CO2和NO2的混合气体,溶液B为硝酸,A与水反应得到的气体为NO和CO2的混合气体,通过石灰水后得气体D为NO,溶液B与过量C得E,E与过量B反应得F,则金属C有可变化合价,所以C为铁,E为硝酸亚铁,白色沉淀与硝酸反应得气体G为CO2,H为常见金属,CO2与H反应得M,则H为Mg,白色固体为MgO,
(1)根据上面的分析可知,C为Fe,D为NO,H为Mg,
故答案为:Fe;NO;Mg;
(2)反应①的化学方程式为C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O,反应②的化学方程式为3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O,反应③的化学方程式为2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C,
故答案为:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;3Fe(NO3)2+4HNO3=3Fe(NO3)3+NO↑+2H2O;2Mg+CO2$\frac{\underline{\;点燃\;}}{\;}$2MgO+C.
点评 本题考查无机物推断,涉及Fe、N元素化合物的性质与转化,物质间的反应特征是推断突破口,需要熟练掌握元素化合物知识,题目难度较大.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 元素Y、Z、W形成的离子具有相同电子层结构,其离子半径依次增大 | |
| B. | 39g Z2Y2中含有的离子数约为1.204×1024 | |
| C. | 元素Z、R的氧化物的水化物之间相互反应生成的盐溶液一定呈中性 | |
| D. | 元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
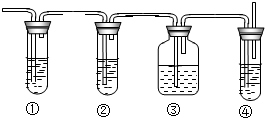 实验室里用乙醇和浓硫酸来制取乙烯:
实验室里用乙醇和浓硫酸来制取乙烯:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯碱工业中电解饱和食盐水的原理示意图如图所示
氯碱工业中电解饱和食盐水的原理示意图如图所示查看答案和解析>>
科目:高中化学 来源: 题型:解答题
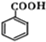 .
. (任选一种).
(任选一种).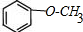 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 称量时,将固体NaOH放在小烧杯中,再放在天平左盘上 | |
| B. | 将称量好的固体NaOH放入容量瓶中,加蒸馏水溶解 | |
| C. | 定容时如果加水超过了刻度线,用胶头滴管直接吸出多余部分 | |
| D. | 将烧杯中溶解固体NaOH所得溶液,冷却到室温后转移至容量瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
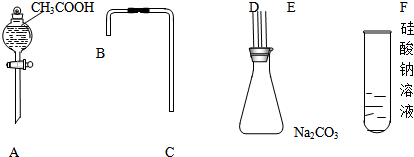
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度、温度、压强、催化剂既是影响反应速率的因素又是影响反应限度的因素 | |
| B. | 合成氨反应在一定条件下达到平衡后,N2、H2、NH3物质的量之比保持恒定 | |
| C. | 化学反应的限度决定于反应物的性质,与外界条件无关 | |
| D. | 增大反应物的用量一定会加快反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④②①③ | D. | ③②①④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com