





科目:高中化学 来源:不详 题型:实验题
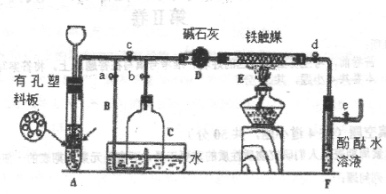
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
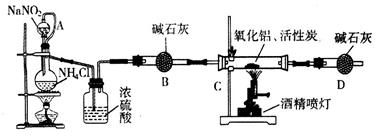
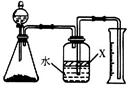 。
。查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
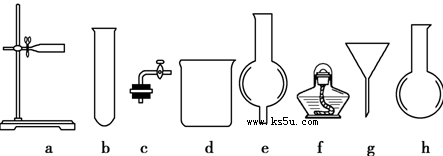
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 K2MnO4+MnO2+ O2↑
K2MnO4+MnO2+ O2↑ 4H2O+2N2↑+ O2↑
4H2O+2N2↑+ O2↑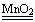 2H2O +O2↑
2H2O +O2↑ 2NO+ O2↑
2NO+ O2↑| A.只有① | B.①和② | C.①和③ | D.①③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| | 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
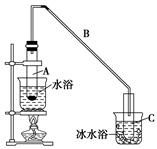
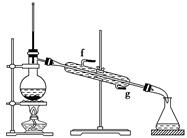
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
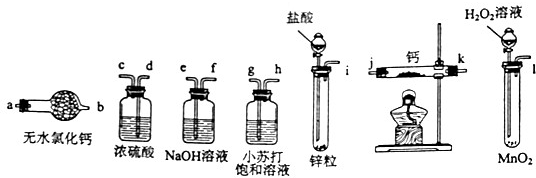
| A.加热反应一段时间 | B.收集气体并检验其纯度 |
| C.关闭分液漏斗活塞 | D.停止加热,充分冷却 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.酒精 | B.四氯化碳 | C.乙酸 | D.苯(E)水 |
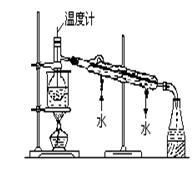
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com