
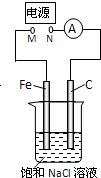
| A. | 去掉电源,将M、N用导线直接相连,则Fe棒上产生气泡 | |
| B. | M接电源负极,N接电源正极,Fe棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| C. | M接电源正极,N接电源负极,将石墨棒换成Cu棒,电解质溶液换成CuSO4溶液,则可实现在铁棒上镀铜 | |
| D. | 去掉电源,将M、N用导线直接相连,烧杯中的溶液换成经酸化的3% NaCl溶液,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀 |
分析 A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上失电子发生氧化反应;
B.M连接电源负极,N连接正极,则该装置是电解池,铁作阴极,石墨作阳极;
C.M接电源正极,N接电源负极,将C电极换成Cu电极,Fe在阳极失电子;
D.去掉电源,该装置是原电池,铁在负极失去电子生成亚铁离子.
解答 解:A.去掉电源,该装置是原电池,铁发生吸氧腐蚀,铁棒上的电极反应式为:Fe-2e-=Fe2+,故A错误;
B.M连接电源正极,N连接负极,则该装置是电解池,铁作阴极,石墨作阳极,铁不被腐蚀,属于外加电源的阴极保护法,故B错误;
C.M接电源正极,N接电源负极,将C电极换成Cu电极,阳极发生Fe-2e-=Fe2+,阴极发生Cu2++2e-=Cu,不能实现在铁上镀铜,故C错误;
D.去掉电源,该装置是原电池,铁在负极失去电子生成亚铁离子,向Fe电极区滴入2滴K3[Fe(CN)6]溶液,反应一段时间后,烧杯中产生蓝色沉淀,故D正确;
故选D.
点评 本题考查电解池和原电池原理,明确离子放电顺序是解本题关键,注意电解池中如果活泼金属作阳极,则阳极上金属电极失电子而不是溶液中阴离子失电子,为易错点.


 优质课堂快乐成长系列答案
优质课堂快乐成长系列答案科目:高中化学 来源: 题型:选择题
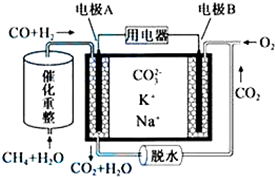
| A. | 反应CH4+H2O$\frac{\underline{催化剂}}{△}$3H2+CO,每消耗1molCH4转移12mol电子 | |
| B. | 电极A上H2参与的电极反应为:H2+2OH--2e-=2H2O | |
| C. | 电池工作时,CO32-向电极B移动 | |
| D. | 电极B上发生的电极反应为:O2+2CO2+4e-=2CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
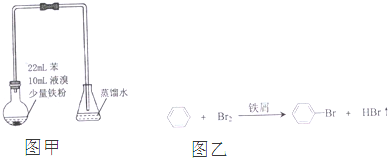
| A. | 制备溴苯的反应属于取代反应 | |
| B. | 白雾出现是因为HBr易挥发且极易溶于水 | |
| C. | 装置图中长直玻璃导管仅起导气作用 | |
| D. | 溴苯中溶有少量的溴,可用NaOH溶液洗去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | X如果是硫酸铜,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| B. | X如果是氯化钠,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 | |
| C. | X如果是硫酸铁,则不论a和b是否用导线连接,铁片均发生氧化反应 | |
| D. | X如果是氢氧化钠,将碳电极改为铝电极,a和b用导线连接,此时构成原电池铁作负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸碱中和滴定需将标准溶液直接注入到用水清洗后的滴定管中 | |
| B. | 若需94 mL1.00mol/LNaCl溶液,需称5.85g NaCl配制成100mL溶液 | |
| C. | 用一元酸和一元碱测定中和反应热时,取等体积等浓度的稀溶液为佳 | |
| D. | 测定稀酸或稀碱溶液的pH时,需将待测液直接滴在湿润的pH试纸上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
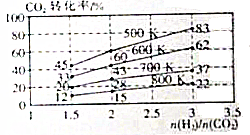 二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.
二氧化碳是造成温室效应的主要气体,二氧化碳的回收在利用是减缓温室效应的有效途径之一.| 温度/K CO2转化率/% a/mol | 500 | 600 | 700 | 800 |
| 1.67 | x | 33 | ||
| 1.25 | 60 | 43 | y | |
| 0.83 | z | 32 | w |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
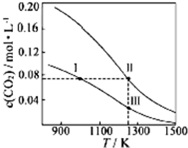 在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )
在体积均为1.0L的量恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1molCO2和0.2molCO2,在不同温度下反应CO2(g)+C(s)?2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上).下列说法正确的是( )| A. | 反应CO2(g)+C(s)?2CO(g)的△S>0、△H<0 | |
| B. | 体系的总压强P总:P总(状态Ⅱ)>2P总(状态Ⅰ) | |
| C. | 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ) | |
| D. | 逆反应速率V逆:V逆(状态Ⅰ)>V逆(状态Ⅲ) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com