
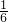 来自KClO3,
来自KClO3,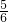 来自HCl,KCl中的Cl全部来自HCl,故D错误.
来自HCl,KCl中的Cl全部来自HCl,故D错误.

 黎明文化寒假作业系列答案
黎明文化寒假作业系列答案科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题




查看答案和解析>>
科目:高中化学 来源: 题型:单选题
 8Na2CrO4+2Fe2O3+8CO2
8Na2CrO4+2Fe2O3+8CO2查看答案和解析>>
科目:高中化学 来源: 题型:解答题
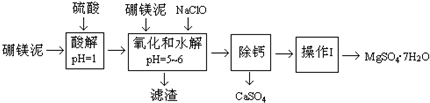
| 温度(°C) | 40 | 50 | 60 | 70 |
| MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
| CaSO4 | 0.210 | 0.207 | 0.201 | 0.197 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
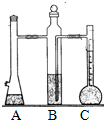 利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:
利用如图装置可以测定常温下1mol氢气的体积,某同学的实验数据以及计算结果如下:| 实验次数 | 镁带质量(g) | 硫酸体积(ml) | C装置中液体的体积(ml) | 最后抽气的体积(ml) | 氢气的体积(ml) | 计算1mol氢气的体积(L) |
| ① | 0.125 | 10 | 128.5 | 3.0 | 121.5 | 23.34 |
| ② | 0.133 | 10 | 135.5 | 3.0 | 128.5 | 23.19 |
| ③ | 0.127 | 10 | 129.7 | 3.0 | 122.7 | 23.19 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com