
| A. | NaAlO2溶液和盐酸 | B. | NaHCO3溶液和Ca(OH)2溶液 | ||
| C. | Ba(OH)2溶液和浓MgCl2溶液 | D. | 稀硫酸和碳酸氢钠溶液 |
分析 A.NaAlO2溶液和盐酸反应产物与盐酸的量的多少有关;
B.NaHCO3溶液和Ca(OH)2溶液反应产物和量的多少无关;
C.Ba(OH)2溶液和浓MgCl2溶液混合生成沉淀;
D.稀硫酸和碳酸氢钠溶液混合就会产生二氧化碳.
解答 解:A.NaAlO2溶液中加入盐酸,开始时会出现白色沉淀,随盐酸加入,沉淀逐渐消失,NaAlO2溶液加入到盐酸中,开始无沉淀,随着偏铝酸钠的加入逐渐产生白色沉淀,现象不一样,通过相互滴加就可以鉴别,故A正确;
B.NaHCO3溶液和Ca(OH)2溶液反应均会出现碳酸钙白色沉淀,相互滴加的现象一样,不能通过相互滴加来鉴别,故B错误;
C.Ba(OH)2溶液和浓MgCl2溶液反应生成氢氧化镁沉淀,相互滴加的现象一样,不能通过相互滴加来鉴别,故C错误;
D.稀硫酸和碳酸氢钠溶液混合就会产生二氧化碳,相互滴加的现象一样,不能通过相互滴加来鉴别,故D错误.
故选A.
点评 本题考查物质的检验和鉴别,侧重于元素化合物知识的综合应用,为高考常见题型,注意把握相关物质的性质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | NH4Cl的电子式: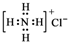 | B. | Cl-的结构示意图: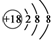 | ||
| C. | 中子数为21的钾原子:${\;}_{19}^{40}$K | D. | 对硝基苯酚的结构简式: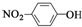 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
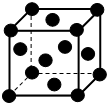 经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )
经探明我国在沿海大陆架和西藏地区蕴含丰富的可燃冰即甲烷水合物,如图是一种甲烷晶体的结构,图中每个小球代表一个甲烷分子(甲烷分子分别位于立方体的顶点和面心),下列有关该晶体说法正确的是( )| A. | 该晶体与氯化钠的晶体类型相同 | |
| B. | 该晶体熔化只需要破坏共价键 | |
| C. | SiH4分子的稳定性强于甲烷 | |
| D. | 每个顶点的甲烷与之距离最近的甲烷分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子化合物中一定含有离子键 | |
| B. | 单质分子中均不存在化学键 | |
| C. | 全部由非金属元素形成的化合物中不可能含有离子键 | |
| D. | 含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的 |
| A | 将二氧化硫气体通入紫色石蕊试液中,观察溶液颜色变化 | 证明二氧化硫具有漂白性 |
| B | 验证电离H+的能力HClO>HCO3- | 向 NaHCO3溶液中加入新制氯水,观察溶液中是否有气泡冒出 |
| C | 相同条件下,向两支盛有相同体积不同浓度H2O2溶液的试管中分别滴入适量相同浓度的CuSO4溶液和FeCl3溶液 | 探究Cu2+、Fe3+对H2O2分解速率的影响 |
| D | 向2mL品红溶液和2mL加入少许醋酸的品红溶液中分别滴入3滴84消毒液,观察红色褪色的快慢 | 证明随溶液pH的减少,84消毒液的氧化能力增强 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入足量的溴水 | B. | 通入足量的酸性高锰酸钾溶液 | ||
| C. | 在导管口点燃 | D. | 一定条件下与H2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.
CO2 和CO与我们的社会生活联系相当密切,某化学课题组对此进行了探究.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com