(Ⅰ)实验室中盐酸的用途十分广泛,常常用来制备气体.
(1)某小组同学欲用4mol/L的盐酸配制230mL 0.4mol/L 盐酸溶液,需取用4mol/L盐酸
25
25
mL,实验中需要用到的玻璃仪器有
烧杯
烧杯
、
250ml容量瓶
250ml容量瓶
、量筒、烧杯、胶头滴管.
(2)下列实验操作使配制的溶液浓度偏低的是
BC
BC
A.容量瓶洗涤后未干燥
B.移液时,有少量溶液溅出
C.定容时,加水不慎超过刻度线,又倒出一些
D.定容时,俯视刻度线
E.装入试剂瓶时,有少量溶液溅出
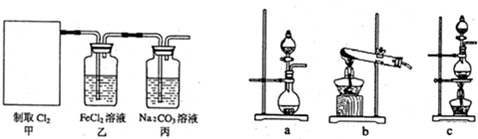
(Ⅱ)瑞典化学家舍勒将软锰矿(主要成分为MnO
2)与浓盐酸混合加热,在世界上首先得到了氯气.已知Cl
2和碱溶液在不同条件下,得到的产物不同,某兴趣小组用下图所示装置制取氯酸钾、次氯酸钠和探究氯水的性质.( 3Cl
2+6KOH
KClO
3+5KCl+3H
2O )图中:A为氯气发生装置;B的试管里盛有15mL 30% KOH溶液,并置于水浴中;C的试管里盛有15mL 8% NaOH溶液,并置于冰水浴中;D的试管里加有紫色石蕊试液.
请填写下列空白:
(1)制取氯气时,在圆底烧瓶里加入一定质量的二氧化锰,通过
分液漏斗
分液漏斗
(填仪器名称)向圆底烧瓶中加入适量的浓盐酸.装置A中反应的离子方程式
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
.
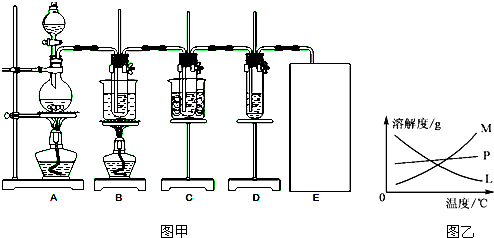
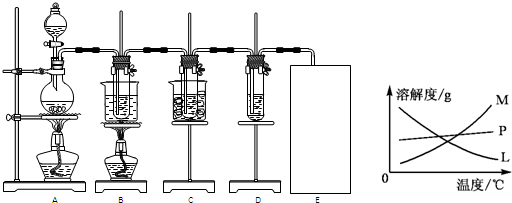
(2)反应完毕经冷却后,B的试管中有大量晶体析出.图中符合该晶体溶解度曲线的是
M
M
(填编号字母);从B的试管中分离出该晶体的方法是
过滤
过滤
(填实验操作名称).该小组同学发现制得的氯酸钾产量偏低,可能的一种原因是Cl
2中含有杂质,该杂质成分
HCl
HCl
(除水蒸气外,填化学式),如何改进
AB间增加一个盛有饱和氯化钠溶液吸收氯化氢的洗气装置
AB间增加一个盛有饱和氯化钠溶液吸收氯化氢的洗气装置
;
(3)实验中可观察到D的试管里溶液的颜色发生了如下变化,请填写下表中的空白:
| 实验现象 |
原因 |
| 溶液最初从紫色逐渐变为 红 红 色 |
氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 |
氯气与水反应生成的HClO将石蕊氧化为无色物质 氯气与水反应生成的HClO将石蕊氧化为无色物质 |
(4)请在装置图方框中画出缺少的实验装置,并注明试剂.