
 结构;
结构;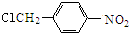 $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$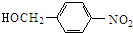 $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$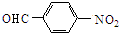
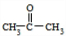 ;E
;E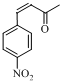
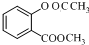 $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$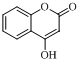 +CH3OH.
+CH3OH. 分析 由E、F分子式与新抗凝的结构简式可知,E与H发生加成反应生成新抗凝,可推知E为 ,H为
,H为 .C与D发生信息中反应得到E,可推知C为
.C与D发生信息中反应得到E,可推知C为 ,D为
,D为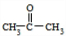 .甲苯发生甲基对位的硝化反应生成A为
.甲苯发生甲基对位的硝化反应生成A为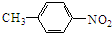 ,A与氯气发生取代反应生成B为
,A与氯气发生取代反应生成B为 ,发生水解反应生成
,发生水解反应生成 ,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为
,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为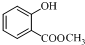 ,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为
,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为 .
.
解答 解:由E、F分子式与新抗凝的结构简式可知,E与H发生加成反应生成新抗凝,可推知E为 ,H为
,H为 .C与D发生信息中反应得到E,可推知C为
.C与D发生信息中反应得到E,可推知C为 ,D为
,D为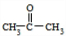 .甲苯发生甲基对位的硝化反应生成A为
.甲苯发生甲基对位的硝化反应生成A为 ,A与氯气发生取代反应生成B为
,A与氯气发生取代反应生成B为 ,发生水解反应生成
,发生水解反应生成 ,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为
,再发生氧化反应生成C.水杨酸与甲醇发生酯化反应生成F为 ,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为
,F与乙酸酐反应生成G,G发生信息中反应得到H,可知G为 .
.
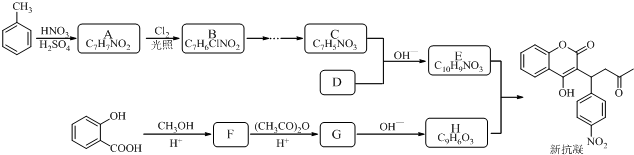
(1)同时符合下列条件的A( )的所有同分异构体:①红光光谱标明分子中含有
)的所有同分异构体:①红光光谱标明分子中含有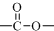 结构,说明含有羧基或酯基,②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子,符合条件的同分异构体有:
结构,说明含有羧基或酯基,②1H-NMR谱显示分子中含有苯环,且苯环上有三种不同化学环境的氢原子,符合条件的同分异构体有: ,
,
故答案为: ;
;
(2)B→C的合成路线流程图: $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$ ,
,
故答案为: $→_{△}^{NaOH水溶液}$
$→_{△}^{NaOH水溶液}$ $→_{催化剂}^{O_{2}}$
$→_{催化剂}^{O_{2}}$ ;
;
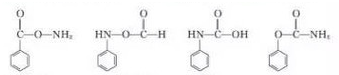
(3)A.化合物B为 ,不能使Br2/CCl4溶液褪色,故A错误;
,不能使Br2/CCl4溶液褪色,故A错误;
B.化合物C为 ,含有醛基,能发生银镜反应,故B正确;
,含有醛基,能发生银镜反应,故B正确;
C.化合物F为 ,含有酚羟基,能与FeCl3发生显色反应,故C正确;
,含有酚羟基,能与FeCl3发生显色反应,故C正确;
D.由新抗凝的结构简式,可知其分子式为C19H15NO6,故D正确,
故选:A;
(4)D的结构简式为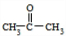 ,E的结构简式为:
,E的结构简式为: ,故答案为:
,故答案为: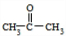 ;
; ;
;
(5)G→H的化学方程式是: $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ +CH3OH,故答案为:
+CH3OH,故答案为: $\stackrel{OH-}{→}$
$\stackrel{OH-}{→}$ +CH3OH.
+CH3OH.
点评 本题考查有机物的推断与合成,充分利用有机物的分子式、结构简式分析,侧重考查学生分析推理能力,对信息的获取与迁移运用能力,难度中等.


科目:高中化学 来源: 题型:解答题
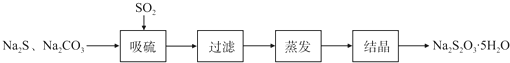
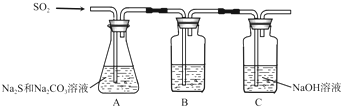
| 序号 | 实验操作 | 预期现象 | 结论 |
| ① | 取少量样品于试管中,加入适量蒸馏水,充分振荡溶解,滴加足量稀硝酸,再滴加少量AgNO3溶液,振荡. | 有白色沉淀生成 | 样品含NaCl |
| ② | 另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,另取少量样品于烧杯中,加入适量蒸馏水,充分搅拌溶解,加入过量CaCl2溶液,搅拌,静置,用pH计测定上层清液pH | 有白色沉淀生成,上层清液pH大于10.2 | 样品含NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10min内,Y的平均反应速率为0.03 mol•Lˉ1•sˉ1 | |
| B. | 第10min时,X的反应速率为0.01 mol•Lˉ1•minˉ1 | |
| C. | 10min内,消耗0.2 mol X,生成0.4 mol Z | |
| D. | 10min内,X和Y反应放出的热量为a kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
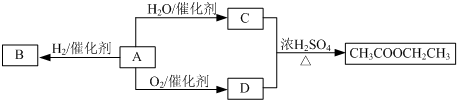
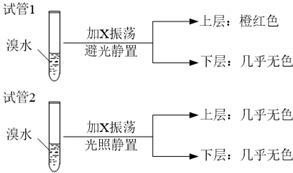
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
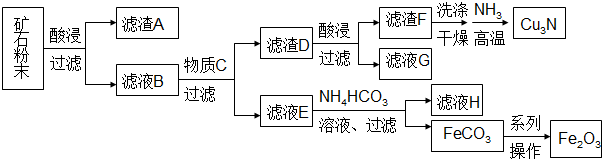
| A. | 每生成1mol Cu3N,转移的电子为6mol | |
| B. | 滤液G可以并入滤液E加以利用 | |
| C. | 加入NH4HCO3溶液需控制温度以抑制Fe2+水解和NH4HCO3分解 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 步骤Ⅰ中减少的3 g固体一定是混合物 | |
| B. | 步骤Ⅱ中质量减少的物质一定是Cu | |
| C. | 根据步骤Ⅰ、Ⅱ可以判断混合物X的成分为Al2O3、Fe2O3、Cu、SiO2 | |
| D. | 根据步骤Ⅱ可以得出,m(Fe2O3):m(Cu)=1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
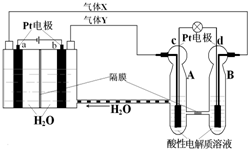 RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )
RFC是一种将水电解技术与氢氧燃料电池技术相互结合的可充电电池,RFC工作原理如图所示.则下列有关说法正确的是( )| A. | c电极发生还原反应,B池中H+通过隔膜进入A池 | |
| B. | b电极上发生的电极反应是:2H2O+2e-═H2↑+2OH- | |
| C. | 转移0.1mol电子时,a电极产生标准状况O21.12L | |
| D. | d电极上发生的电极反应是:O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
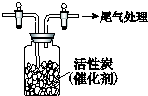 某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.
某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com