
【题目】氟磷灰石是常见的钙氟磷酸盐矿物,其化学式为Ca5(PO4)3F,由氟磷灰石制取黄磷(P4)的化学式为4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g),请回答下列问题:
(1)基态Ca原子电子所占据最高能级的电子云轮廓图为________,基态P原子的价电子轨道表达式为________。
(2)由氟磷灰石制取黄磷(P4)产物中属于极性分子的化合物是________,与其互为等电子体的分子为________。
(3)黄磷(P4)晶体的空间结构如图甲所示,P的杂化轨道类型为________,磷的一种硫化物P4S3的空间结构如图乙所示,每个S原子中含有孤电子对的数目为________。


(4)SiO2的沸点________(填“大于”或“小于”)CO2的沸点,其原因为________。
(5)Ca与Ti、O元素形成的化合物的晶胞结构如图所示,则该晶体的化学式为________,若晶胞密度为ρgcm-3,阿伏加德罗常数的值为NA,则该晶胞中两个距离最近的O原子之间的距离为________pm(用含ρ、NA的表达式表示)。

【答案】球形 ![]() CO N2 sp3杂化 2 大于 SiO2为原子晶体,CO2为分子晶体,原子晶体的熔沸点比分子晶体的熔沸点高 CaTiO3
CO N2 sp3杂化 2 大于 SiO2为原子晶体,CO2为分子晶体,原子晶体的熔沸点比分子晶体的熔沸点高 CaTiO3 ![]()
【解析】
(1)基态Ca原子的价电子排布式为4s2,电子所占据最高能级为4s;基态P原子的价电子排布式为3s23p3。
(2)由氟磷灰石制取黄磷(P4)产物中P4、SiF4为非极性分子,CaSiO3为离子化合物,CO为极性分子,若两种离子或分子含有相同的原子数和价电子总数则互为等电子体。
(3)根据价层电子互斥理论进行判断。
(4)原子晶体的熔沸点比分子晶体的熔沸点高。
(5)根据“均摊法”进行计算。
(1)基态Ca原子的价电子排布式为4s2,电子所占据最高能级为4s,其电子云轮廓图为球形,基态P原子的价电子排布式为3s23p3,其价电子轨道表达式也就是价电子排布图为![]() 。
。
(2)由氟磷灰石制取黄磷(P4)产物中P4、SiF4为非极性分子,CaSiO3为离子化合物,CO为极性分子,若两种离子或分子含有相同的原子数和价电子总数则互为等电子体,故与CO互为等电子体的分子为N2。
(3)黄磷(P4)晶体的空间构型为正四面体,每个P原子含有的价层电子对数为3+(5-3)÷2=4,故P原子的杂化轨道类型为sp3杂化,P4S3中每个S原子与两个P原子以单键相连,S原子的价层电子对数为2+(6-2)÷2=4,故S原子有两对成键电子对和两对孤电子对。
(4)SiO2的沸点大于CO2的沸点,其原因为SiO2为原子晶体,CO2为分子晶体,原子晶体的熔沸点比分子晶体的熔沸点高。
(5)根据“均摊法”可知,该晶胞中含有1个Ca2+、1个Ti4+和3个O2-,故其化学式为CaTiO3,设该晶胞参数为acm,则有![]() ,
,![]() ,两个最近的O原子之间的距离为
,两个最近的O原子之间的距离为![]() 单位换算可知结果为
单位换算可知结果为![]() 。
。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如图所示,下列关于RCl5分子的说法中不正确的是( )
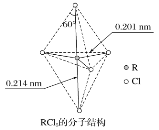
A.并不是每个原子都达到8电子稳定结构
B.键角(Cl—R—Cl)有90°、120°、180°几种
C.RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
D.分子中5个R—Cl键键能不都相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属晶体的原子堆积方式常有以下四种,请认真观察模型(见图),回答下列问题:
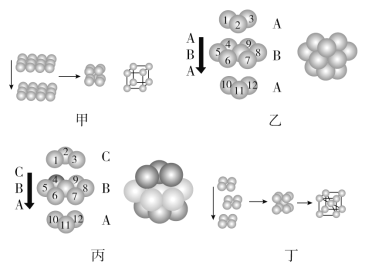
(1)四种堆积模型的堆积名称依次是________、________、________、________。
(2)甲堆积方式中的空间利用率为________,只有金属________采用这种堆积方式。
(3)乙与丙中两种堆积方式中金属原子的配位数________(填“相同”或“不相同”);乙中的空间利用率为________。
(4)采取丁中堆积方式的金属通常有________(任写三种金属元素的符号),每个晶胞中所含有的原子数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某硫酸工厂排放的尾气中,含少量的二氧化硫。如果将一定体积的尾气通入100mL2mol/L的氢氧化钠溶液使其完全反应,经测定所得溶液含有16.7g溶质。试分析该溶液的成分,并计算确定各成分的物质的量___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,4-环己二酮是一种重要的医药、液晶中间体。以工业原料乙烯为基础的1,4-环已二酮(G)合成线路如图所示:
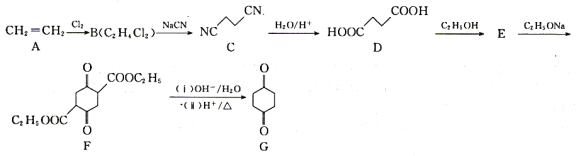
已知:2RCH2COOC2H5![]() +C2H5OH
+C2H5OH
(1)B和E的结构简式分别为________、________。
(2)B→C的反应类型为________。
(3)碳原子上连有4个不同的原子或基团时,该碳称为手性碳,用星号(*)标出F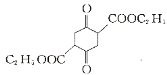 中的手性碳________。
中的手性碳________。
(4)由E→F的化学方程式为________。
(5)同时满足下列条件的G的同分异构体的结构简式________(不考虑立体异构)。
①能发生银镜反应;
②核磁共振氢谱显示为2个峰,且峰面积之比为3:1。
(6)设计由乙烯(CH2=CH2)和乙醇(C2H5OH)制备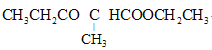 的合成路线________(无机试剂任选)
的合成路线________(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是( )
A.向AlCl3溶液中滴加氨水,产生白色沉淀;再加入NaHSO4溶液,沉淀溶解
B.在Cu(NO3)2溶液中加入铜粉,铜粉不溶解;再加入稀硫酸溶液,铜粉溶解
C.用如图所示的装置可以测定黄铜(Cu,Zn合金)中Zn的含量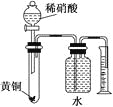
D.在FeCl3溶液中加入KSCN溶液,溶液变红,加入足量铁粉充分振荡,溶液红色褪去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物A的红外光谱和核磁共振氢谱如图所示,下列说法中错误的是( )
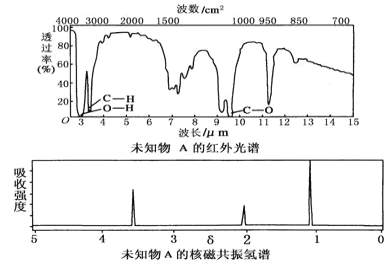
A.由红外光谱可知,该有机物中至少有三种不同的化学键
B.由核磁共振氢谱可知,该有机物分子中有三种不同化学环境的氢原子
C.仅由其核磁共振氢谱无法得知其分子中的氢原子总数
D.若A的化学式为C2H6O,则其结构简式为CH3—O—CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
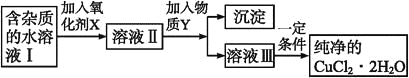
【题目】在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。现有含氯化亚铁杂质的氯化铜晶体(CuCl2·2H2O),为制取纯净的CuCl2·2H2O,首先将其制成水溶液,然后按如图步骤进行提纯:
已知某温度下:Cu2+、Fe3+和Fe2+的氢氧化物开始沉淀和沉淀完全时的pH,见下表:
Fe3+ | Fe2+ | Cu2+ | |
氢氧化物开始沉淀时的pH | 1.9 | 7.0 | 4.7 |
氢氧化物完全沉淀时的pH | 3.2 | 9.0 | 6.7 |
请回答下列问题:
(1)加入氧化剂X的目的是_______________________。
(2)最适合作氧化剂X的是___________(填编号,否则不给分);写出氧化剂X参与的离子反应方程式_________。
A.K2Cr2O7 B.NaClO C.H2O2 D.KMnO4
(3)为了除去Fe3+,需加入物质Y_________(填化学式)调节溶液的pH值为___________。
(4)最后能不能直接蒸发结晶得到CuCl2·2H2O晶体?________(填“能”或“不能”);若能,不用回答;若不能,回答该如何操作?____________________。
(5)常温下已知Fe(OH)3的Ksp=1.0×10-35,向500mL 0.2mol/L的FeCl3溶液中加入NaOH固体(溶液体积变化忽略不计)后pH=3.0,则需要加入氢氧化钠固体的质量为________g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com