
分析 (1)硫酸氢钠是一种强酸性的盐,在水溶液中完全电离出三种离子;
(2)电离生成金属阳离子(或铵根离子)和酸根离子的化合物叫做盐;
(3)根据NaHSO4与Ba (OH)2在溶液中离子之间反应的实质来回答.
解答 解:(1)硫酸氢钠在水溶液中完全电离出三种离子,即NaHSO4=Na++H++SO42-,故答案为:NaHSO4=Na++H++SO42-;
(2)NaHSO4电离生成了金属阳离子和酸根离子,属于盐类,
故答案为:盐;NaHSO4在水溶液中电离出金属阳离子和酸根离子;
(3)NaHSO4与Ba (OH)2在溶液中按物质的量之比为2:1混合时,酸碱恰好中和,实质是:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O,
故答案为:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O.
点评 本题考查电离方程式和离子方程式的书写,明确电解质的强弱及离子反应中物质的量的关系是解答的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
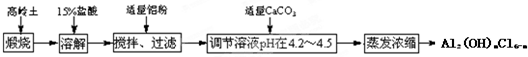
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+═CO2↑+H2O | |
| B. | 硫酸铜溶液中滴加氢氧化钡溶液:Ba2++2OH-+Cu2++SO42-═BaSO4↓+Cu(OH)2↓ | |
| C. | 硝酸银溶液中加入铜粉:Ag++Cu═Cu2++Ag↓ | |
| D. | 铁与稀盐酸反应:2Fe+6H+═2Fe3++3H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释 | |
| B. | 乳酸[CH3CH(OH)COOH]中存在一个手性碳原子 | |
| C. | 许多过渡金属离子对多种配体具有很强的结合力,因而,只有过渡金属才能形成配合物 | |
| D. | 已知酸性:H3PO4>HClO,是因为H3PO4分子中有1个非羟基氧原子为0 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次月考化学卷(解析版) 题型:选择题
可逆反应2SO2(g)+O2(g)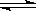 2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
2SO3(g)从正方向开始,并达到了平衡。此时SO2和O2的物质的量之比为2∶1;若采取某种措施,导致SO2和O2又消耗了一些,并再次达到平衡,下列说法正确的是( )
A .新平衡体系中,SO2和O2物质的量之比仍为2∶1
B .平衡向正反应方向移动了,原因是正反应速率增大了,逆反应速率减小了
C .新平衡体系与旧平衡体系比较,SO3的浓度肯定增大了
D .若采取的措施是缩小容器的容积,则新旧平衡中SO2和O2的转化率之比都是1∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com