
【题目】(1)已知反应:Na2S2O3+H2SO4=Na2SO4+S↓+SO2+H2O。甲同学通过测定该反应发生时溶液变浑浊的时间,研究外界条件对化学反应速率的影响。设计实验如下:
实验编号 | 实验温度/℃ | c(Na2S2O3)/mol·L-1 | V(Na2S2O3)/mL | c(H2SO4)/mol·L-1 | V(H2SO4)/mL | V(H2O)/mL |
① | 25 | 0.1 | 5.0 | 0.1 | 10.0 | a |
② | 25 | 0.1 | 10.0 | 0.1 | 10.0 | 0 |
③ | 25 | 0.2 | 5.0 | 0.1 | 5.0 | b |
④ | 50 | 0.2 | 5.0 | 0.1 | 10.0 | 5.0 |
其他条件不变时:探究温度对化学反应速率的影响,应选择实验__________(填实验编号);若同时选择实验①②、实验②③,测定混合液变浑浊的时间,可分别探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,则表中a和b分别为________和________。
(2)某同学设计如下实验流程探究Na2S2O3的化学性质。
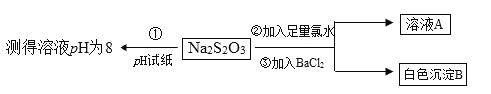
实验操作①中测试时pH试纸的颜色应该接近_____________。
A.红色 B.黄色 C.深蓝色 D.绿色
上述流程中实验②、③的目的是为了探究Na2S2O3某种化学性质,你认为是探究了Na2S2O3的_____性。
【答案】②④ 5.0 10.0 D 还原
【解析】
(1)探究温度对速率的影响时,其他条件要保持不变,使温度成为唯一变量,实验①、实验②和实验③的温度相同,浓度不同,反应物的浓度为变量,注意溶液总体积应相同;
(2)Na2S2O3属于强碱弱酸盐,水解显碱性,PH=8在标准比色卡对应的颜色为绿色;氯水具有强氧化性的溶液,白色沉淀B为硫酸钡。
(1)其他条件不变探究温度对化学反应速率的影响时,要让浓度保持一致,温度成为唯一变量,②④这两组所取反应物的物质的量是相同的,溶液的总体积也相同,浓度一致,因此可选②④,实验①、实验②和实验③的温度相同,探究Na2S2O3浓度和H2SO4的浓度对化学反应速率的影响,其他条件一致,溶液总体积保持一样,根据②可知溶液总体积为20.0 mL,所以a=20.0mL5.0mL15.0mL=5.0mL,
b=20.0mL5.0mL5.0mL=10.0mL,
故答案为:②④;5.0;10.0;
(2)pH=8对应标准比色卡对应的颜色为绿色;白色沉淀B为硫酸钡,加入氯水的目的是把S2O32氧化为硫酸根离子,表现了Na2S2O3的还原性,
故答案为:D;还原。


科目:高中化学 来源: 题型:
【题目】A、B、 C、D是原子序数依次增大的五种短周期主族元素。B、C、E最外层电子数之和为11;A 原子核外最外层电子数是次外层的2倍;C是同周期中原子半径最大的元素;工业上一般通过电解氧化物的方法制备D的单质;E单质是制备太阳能电池的重要材料。下列说法正确的是( )
A. 简单离子半径:B>C
B. 最高价氧化物对应水化物的酸性: A<E
C. 工业上不用电解氯化物的方法制备单质D是由于其氯化物的熔点高
D. 相同质量的C和D单质分别与足量稀盐酸反应,前者生成的氢气多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的Mg和Al混合物投入到200mL稀硫酸中,固体全部溶解后,向所得溶液中滴加NaOH溶液至过量,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。则下列说法不正确的是( )
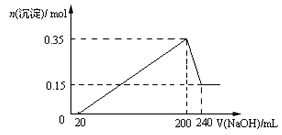
A. Mg和Al的总质量为9g
B. 最初20mLNaOH溶液用于中和过量的稀硫酸
C. NaOH溶液物质的量浓度为5mol·L-1
D. 生成的氢气在标准状况下的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】偏二甲肼与![]() 是常用的火箭推进剂,二者发生如下化学反应:
是常用的火箭推进剂,二者发生如下化学反应:
![]()
![]()
(1)火箭残骸中常现红棕色气体,原因为:![]()
![]()
当温度升高时,气体颜色变深,则反应![]() 为____
为____![]() 填“吸热”或“放热”
填“吸热”或“放热”![]() 反应。
反应。
(2)在一个体积为1L的恒压密闭容器中充入![]() ,一段时间后达化学平衡状态,反应的化学平衡常数表达式
,一段时间后达化学平衡状态,反应的化学平衡常数表达式![]() _________;反应3s后
_________;反应3s后![]() 的物质的量为
的物质的量为![]() ,则
,则![]() 内的平均反应速率
内的平均反应速率![]() ______
______
(3)在![]() 的平衡体系中,回答下列问题:
的平衡体系中,回答下列问题: ![]() 填“正向”、“逆向”、“不”
填“正向”、“逆向”、“不”![]()
①在溶液中加入少量的KSCN固体,平衡____移动。
②在溶液中加入少量的NaOH固体,平衡_____移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学研究性学习小组设计实验验证NH3能还原CuO,并对还原产物进行探究。请回答下列问题:
Ⅰ.验证NH3能还原CuO

(1)试剂X为___________________________。
(2)请将提供的装置按合理顺序连接。g→_______________________。
(3)装置B的作用是_______________________。
(4)证明NH3能还原CuO的实验现象是_______________________。
II.探充还原产物的成分
【查阅资料】Cu2O粉末呈红色,在酸性溶液中不稳定:Cu2O+H2SO4(稀)=Cu+CuSO4+H2O。
【实验探究】
实验操作 | 实验现象 | 实验结论 |
取10.4g红色固体于烧杯中,加入足量稀硫酸,充分搅拌,静置 | 若无现象 | ①证明红色固体为_________。 |
若溶液变蓝 | ②证明红色固体肯定含有______,可能含有__________。 | |
取上述反应后的混合物过滤、洗涤、干燥、称重,得固体6.4g | ③经计算,红色固体的成分及其物质的量__________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 糖类、油脂、蛋白质在一定条件下均能水解
B. 乙二醇、苯乙烯在一定条件下均可聚合生成高分子化合物
C. 分子式为C4H8C12的有机物共有(不含立体异构)8种
D. ![]() 处于同一平面上的原子数最多为18个
处于同一平面上的原子数最多为18个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组以海水晒盐后的苦囟![]() 含有
含有![]() 为原料,设计制备碘单质
为原料,设计制备碘单质![]() 的转化途径如图,下列说法不正确的是
的转化途径如图,下列说法不正确的是

A.生活中可直接使用![]() 淀粉试纸检验加碘盐中是否含有碘
淀粉试纸检验加碘盐中是否含有碘
B.途径Ⅲ发生反应的离子方程式可能是![]()
C.由图可知氧化性的强弱顺序为![]()
D.两种途径得到等量的碘,消耗氯气物质的量比为1:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaOH溶液时,造成所配制溶液浓度偏高的原因可能是( )
A.所用NaOH已潮解
B.定容时,俯视刻度线
C.用带游码的托盘天平称量NaOH固体质量时,误将砝码放在左盘,被称量物放在右盘
D.托盘天平的左右托盘上各放一张纸,调整天平至平衡后,将NaOH固体放在纸上称量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下:
元素 | 相关信息 |
A | 基态原子的价电子排布式为nSnnPn |
B | 元素原子的核外p电子数比s电子数少1个 |
C | 最外层电子数是电子层数的3倍 |
D | 简单离子是第三周期元素中离子半径最小的 |
E | 价电子层中的未成对电子数为4 |
请回答下列问题:
(1)写出下列元素的名称:A______, B_______, C________,D__________
(2)写出C元素在周期表的位置_________,E2+价电子的轨道表示式________________,B元素能量最高的电子为_____轨道上的电子,其轨道呈_______形.
(3)按原子轨道的重叠方式,1molA与C形成的最高价化合物中σ键有______个,π键有______个。
(4)B、C、D的简单离子的半径由大到小的顺序为_____________(用离子符号表示)。
(5)写出C的核外有18个电子的氢化物的电子式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com