
【题目】已知室温时,0.1mol/L某一元酸HA在水中有0.1%发生电离,回答下列问题:
(1)该溶液中c(H+)= .
(2)HA的电离平衡常数K=;
(3)升高温度时,K(填“增大”,“减小”或“不变”).
【答案】
(1)10﹣4mol/L
(2)1×10﹣7
(3)增大
【解析】(1)HA电离出的c(H+)为0.1mol/L×0.1%=10﹣4mol/L,所以答案为:10﹣4mol/L;(2)由HA═H++Ac﹣ , c(H+)=c(Ac﹣)=10﹣4mol/L,则电离平衡常数为Ka= ![]() =1×10﹣7 , 所以答案为:1×10﹣7;(3)因HA的电离是吸热过程,温度升高促进电离,氢氧根离子、氢离子浓度越大,则K增大,所以答案为:增大;
=1×10﹣7 , 所以答案为:1×10﹣7;(3)因HA的电离是吸热过程,温度升高促进电离,氢氧根离子、氢离子浓度越大,则K增大,所以答案为:增大;
【考点精析】掌握弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 油脂和蛋白质都属于高分子化合物
B. 天然油脂没有固定的熔点和沸点,所以天然油脂是混合物
C. 蚕丝、羊毛、棉花可用来制作纺织品,它们的成分都是蛋白质
D. 葡萄糖与果糖是同分异构体,淀粉与纤维素也是同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同体积、相同pH的某一元强酸溶液①和某一元弱酸溶液②分别与足量的锌粉发生反应,下列关于氢气体积(V)随时间(t)变化的示意图正确的是( )
A.
B.
C.
D.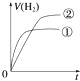
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 
A.氯化钠固体不导电,所以氯化钠是非电解质
B.向纯水中加入碳酸钠能使水的电离平衡正向移动,水的离子积增大
C.如右图研究的是铁的吸氧腐蚀,实验中红色首先在食盐水滴的中心出现
D.常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s) 的△H<0△S<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置进行实验,有关现象和解释均正确的是( )
选项 | 足量 | 甲中试剂 | 乙中试剂 | 现象 | 解释 |
A | CO2 | Na2SiO3 | BaCl2 | 甲浑浊、乙澄清 | 酸性:HCl>H2CO3>H2SiO3 |
B | Cl2 | 紫色石蕊 | Fe(SCN)2 | 开始均变红 | Cl2溶于水显酸性 |
C | SO2 | 品红溶液 | KMnO4 | 均褪色 | SO2具有漂白性 |
D | NH3 | AgNO3 | AlCl3 | 现象相同 | NH3H2O电离出OH﹣ |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在下列指定条件的各溶液中,一定能大量共存的离子组是( )
A.含0.1 molL﹣1SO2的溶液中:Na+、Ba2+、Br﹣、Cl﹣
B.能与金属铝反应放出氢气的溶液中:K+、Mg2+、NO ![]() 、SiO
、SiO ![]()
C.![]() ?=10﹣12的溶液中:K+、NH
?=10﹣12的溶液中:K+、NH ![]() 、SO
、SO ![]() 、NO
、NO ![]()
D.不能使酚酞变红的无色溶液中:Na+、K+、ClO﹣、I﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相关物质的溶度积常数见下表(25℃):
物质 | Mg(OH)2 | CH3COOAg | AgCl | Ag2CrO4 |
Ksp(单位略) | 1.1×10﹣11 | 2.3×10﹣3 | 1.8×10﹣10 | 1.9×10﹣12 |
下列有关说法中不正确的是( )
A.浓度均为0.2 molL﹣1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀
B.将0.001 molL﹣1的AgN03溶液滴入0.001 molL﹣1的KCl和0.001 molL﹣1 的K2CrO4混合溶液中.先产生Ag2CrO4沉淀
C.0.11 molL﹣1的MgCl2溶液中加入氨水产生Mg(OH)2沉淀时溶液的pH为9
D.在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据氧族元素的性质推断,硒不可能具有的性质是( )
A. 单质易溶于水 B. 最高价氧化物对应水化物是酸
C. 单质既有氧化性又有还原性 D. 气态氢化物的稳定性较H2S弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要200mL2.0mol/L的碳酸钠溶液.请回答下列有关问题:
(1)实验中,下列仪器不必使用的是 (填写字母).
A.250mL容量瓶
B.洗瓶
C.托盘天平(药匙)
D.烧瓶
E.玻璃棒
(2)除上述仪器外,尚缺少的仪器或用品有、 .
(3)容量瓶上,除有刻度和容量规格外还应标注 . 容量瓶在使用前必须进行的实验操作是 .
(4)配制过程一般包括:计算、称量、溶解、转移、洗涤、定容、摇匀等步骤,其中所缺的关键步聚是 , 应在之后,之前.
(5)实验评价:
①若配制过程中,向容量瓶中转移溶液时不慎有液滴掉在容量瓶外面,对实验结果有何影响?(填写:偏大、偏小或不影响)
②若在滴加蒸馏水时,不慎超过刻度线,应如何处理? .
(6)计算:所需碳酸钠的质量.(要有过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com