
| A. | ①②③ | B. | ①④⑤⑥ | C. | ①②③④⑤ | D. | ①②③④⑤⑥ |
分析 两种短周期元素X和Y可组成化合物XY3,则X为ⅢA族元素时,Y为ⅤⅡA族元素;或X、Y均为ⅥA族元素;还有可能为X在ⅤA族,Y为ⅤⅡA族或H,以此来解答.
解答 解:XY3中若X为金属,显+3价,则可在ⅢA族,Y显-1价,在ⅦA族.若X、Y同周期,则Y的原子序数为m+4;若Y在X上一周期,则其原子序数为m+4-8=m-4;若Y在X下一周期,则其原子序数为m+4+8=m+12.若X为非金属,则还可能为SO 3、PCl 3、NH 3等,故Y的原子序数依次可表示为m-8、m+2、m-6.
故选D.
点评 本题考查常见的化合物XY3,为高频考点,侧重于学生的分析能力的考查,熟悉元素在周期表中的位置及元素的原子序数的关系即可解答,难度不大.


科目:高中化学 来源: 题型:解答题
 已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).
已知A、B、C、D是中学化学的常见物质,且A、B、C均含有同一种元素.在一定条件下它们之间的相互转化关系如图所示(部分反应中的H2O已略去).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
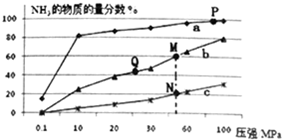 已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.
已知N2(g)+3H2(g)?2NH3(g)△H<0,当反应器中按n(N2):n(H2)=1:3投料后,分别在200℃、400℃、600℃下达到平衡时,混合物中NH3的物质的量分数随压强的变化曲线如图.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
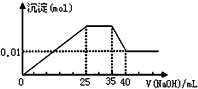 有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH-):H+、NH4+、K+、Fe3+、Mg2+、Cu2+、Al3+、NO3-、CO32-)、SO42-,现取二份100mL溶液进行如下实验:| A. | 原溶液一定不存在H+、Cu2+、CO32-、Fe3+ | |
| B. | 不能确定原溶液是否含有K+、NO3- | |
| C. | 原溶液确定含Mg2+、Al3+、NH4+,且n(Mg2+):n(Al3+):n(NH4+)=1:1:2 | |
| D. | 实验所加的NaOH的浓度为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有漂白性,因而可以使石蕊试液褪色 | |
| B. | 大气中SO2的主要来源是汽车排出的尾气 | |
| C. | SO2是硫酸的酸酐 | |
| D. | SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
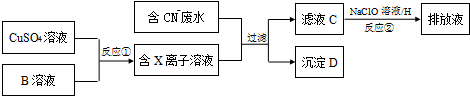
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a点对应的溶液中:Na+、OH-、SO42-、NO3- | |
| B. | b点对应的溶液中:H+、Al3+、NO3-、Cl- | |
| C. | c点对应的溶液中:Na+、Ca2+、NO3-、Cl- | |
| D. | d点对应的溶液中:Cl-、NO3-、Fe2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 适当升高温度 | |
| B. | 将锌粒改为锌粉 | |
| C. | 将所用硫酸改为98%左右的硫酸溶液 | |
| D. | 寻找一种合适的催化剂并加入其中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com