
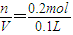 =2mol/L
=2mol/L

 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源:辽宁省大连协作体2010-2011学年高一4月月考化学试题 题型:022
由铜片、锌片和100 mL稀硫酸溶液组成的原电池中,当铜片上产生2.24 L(标态)气体时,硫酸恰好作用完,试计算:
(1)锌片质量减轻了________克.
(2)原稀硫酸溶液的物质的量浓度是________.
查看答案和解析>>
科目:高中化学 来源:陕西省模拟题 题型:填空题
 CO(g)+3H2(g)……Ⅰ
CO(g)+3H2(g)……Ⅰ 
 CH3OH(g);△H<0……Ⅱ。
CH3OH(g);△H<0……Ⅱ。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com