
| A. | 容器中含D物质的量至少为0.45 mol | |
| B. | A的平均反应速率是0.010 mol•L-1•s-1 | |
| C. | 容器中A、B、C、D的物质的量之比一定是4:5:4:6 | |
| D. | 容器中A的物质的量一定增加了0.30 mol |
分析 A.半分钟后,C的物质的量增加了0.30mol,由方程式可知生成的D为0.45mol,D的起始量不一定为0;
B.根据v=$\frac{△c}{△t}$计算v(C),再根据速率之比等于化学计量数之比计算v(A);
C.平衡时各组分的物质的量之比与物质的起始投入的量及转化率有关;
D.A为反应物,C为生成物,C的物质的量增大,则A的一定减小.
解答 解:A.C的物质的量增加了0.30mol,根据方程式4A(g)+5B(g)=4C(g)+6D(g)可知,生成D的物质的量为0.45mol,D的起始量不一定为0,故容器中含D物质的量至少为0.45 mol,故A正确;
B.v(C)=$\frac{\frac{0.3mol}{5L}}{30s}$=0.002mol•L-1•s-1,速率之比等于化学计量数之比,所以v(A)=v(C)=0.002mol•L-1•s-1,故B错误;
C.半分钟后,容器中A、B、C、D的物质的量的比与物质的起始投入的量及转化率有关,可能为4:5:4:6,可能不是,故C错误;
D.C的物质的量增加了0.30mol,根据方程式4A(g)+5B(g)=4C(g)+6D(g)可知,参加反应的A的物质的量为0.3mol,A减小0.3mol,故D错误,
故选:A.
点评 本题考查化学平衡计算、反应速率计算,难度不大,注意物质的起始量不确定,加强基础知识的学习掌握.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:填空题
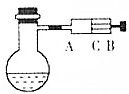 如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:
如图所示,在烧瓶中盛饱和氯水,并滴有酚酞溶液,试填写以下空白:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
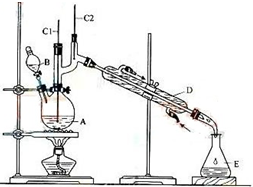 正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:
正丁醛是一种重要的化工原料.肥西中学高二某化学兴趣小组在老师的指导下利用如图装置合成正丁醛.发生的反应如下:| 沸点/.c | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.8109 | 微溶 |
| 正丁醛 | 75.7 | 0.8017 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
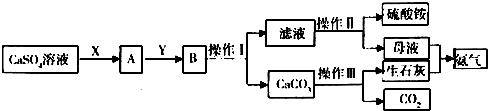
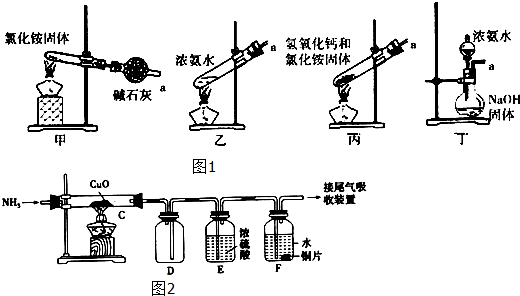
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
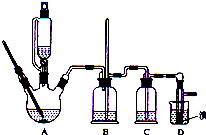 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | -130 | 9 | -116 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/min | 2 | 4 | 7 | 9 |
| n(I2)/mol | 0.012 | 0.011 | 0.010 | 0.010 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、Na+、Cl- | B. | Na+、Cl-、NO3-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | Fe3+、Na+、CO32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com