
【题目】NA代表阿伏加德罗常数的值。下列有关说法正确的是( )
A.38g3H2O2中含有3NA共价键
B.标准状况下,2.24L F2通入足量饱和食盐水中可置换出0.1NA个Cl2
C.常温下,将5.6g铁块投入足量浓硝酸中,转移0.3NA电子
D.1L 0.5mol·L1 pH=7的CH3COONH4溶液中NH4+数目为0.5NA
科目:高中化学 来源: 题型:
【题目】工业上,向500~600 ℃的铁屑中通入氯气生产无水氯化铁。现用如图所示的装置模拟上述过程进行实验。
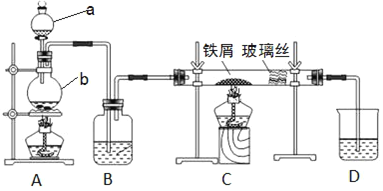
(1)写出仪器的名称:a_______,b________。
(2)A中反应的化学方程式为________。C中反应的化学方程式为________。
(3)装置B中加入的试剂是________。
(4)已知:向热铁屑中通入氯化氢气体可以生产无水氯化亚铁。为防止有杂质FeCl2生成,可在装置__和__(填字母)间增加一个盛有________的洗气瓶。
(5)装置D的作用是________。为防止水蒸气影响无水氯化铁的制取,请你提出一个对装置D的改进方案:________。
(6)反应结束后,取少量装置C中的固体于试管中,加入足量盐酸,固体完全溶解,得到溶液X。证明溶液X中含有FeCl3的试剂是________,观察到的现象是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1。回答有关中和反应的问题:
(1)用0.1molNaOH配成稀溶液与足量稀硝酸反应,放出_____热量。
(2)如图装置中缺少的一种玻璃仪器是___,碎泡沫塑料的作用____。
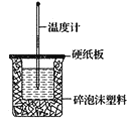
(3)若通过实验测定中和热的ΔH,其结果常常大于-57.3kJ·mol-1,其原因可能是____。
(4)用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热ΔH会___(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的钠、镁、铝与足量盐酸反应时放出氢气的体积比为__________。相同质量的钠、镁、铝与足量盐酸反应时放出氢气的体积比是_________。分别为0.3 mol的钠、镁、铝投入100 mL 1 mol·L-1的硫酸溶液中,三者产生的体积比是______________。
(2)在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。
罐壁内凹而瘪的原因是______________________,离子方程式可能为____________________________;
罐再鼓起的原因是___________________________,离子方程式可能为___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(NOC1)的沸点为-5.5℃,具有刺鼻恶臭味,在潮湿空气中易水解,溶于浓硫酸,是有机合成中的重要试剂。某同学用如图装置,由NO与干燥纯净的Cl2反应制备NOCl。
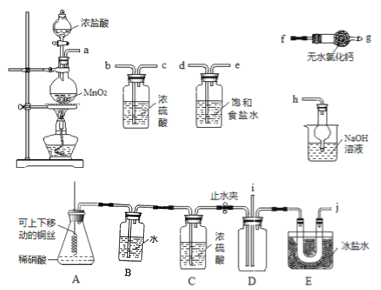
己知:①Cl2沸点为-34.6℃,NO2Cl沸点为-15℃②2NO+Cl2=2NOC1![]() 2NO2+Cl2=2NO2Cl
2NO2+Cl2=2NO2Cl
回答下列问题:
(1)铜与稀硝酸反应的化学方程式为______。
(2)图中实验装置的连接顺序为:a→_______。
(3)实验时,先制取氯气使充满除A、B、C外的整套装置,目的是______;装置中充满氯气后,下—步是制取NO,具体操作是______;E中冰盐水的温度可低至-22℃,其作用是______。
(4)该同学的实验设计可能的不足之处是______(答出一条即可)。
(5)若无C装置,则不利于NOCl的制备,主要原因是______(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用金属铜和稀硝酸制取NO的离子方程式为______________________。
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
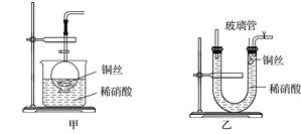
①实验室若没有铜丝,而只有小铜粒,在使用上述装置进行实验时,可用丝状材料包裹铜粒以代替铜丝进行实验,这种丝状材料的成分可以是________(填序号)。
A.铁 B.铝 C.铂 D.玻璃
②打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的,原因是__________(填化学方程式)。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始后,可以在U形管右端观察到无色的NO气体。
①长玻璃管的作用是______________________________________________________。
②让反应停止的操作方法及原因是__________________________________________。
(4)以下收集NO气体的装置,合理的是________(填序号)。
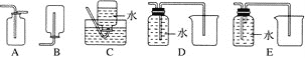
(5)将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答:
①NO的体积为________ L,NO2的体积为________ L。
②待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是( )
A. 小苏打溶液与少量澄清石灰水混合:Ca2++OH-+HCO3-===CaCO3↓+H2O
B. AlCl3溶液中加入足量的氨水:Al3++4OH-===AlO2-+2H2O
C. 将氯气通入水中:Cl2+H2O===Cl-+ClO-+2H+
D. 向Fe(NO3)2溶液中加入稀盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述错误的是( )
A.NaH与H2O反应生成氢气,每生成0.6g氢气转移电子数为0.6NA
B.12g镁在空气中充分燃烧,电子转移数目为NA
C.0.1 mol熔融NaHSO4中含有阳离子数目为0.1NA
D.标准状况下,6.72 L O2和N2的混合气体含有的原子数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学欲通过实验验证氯元素的非金属性强于硫元素。请帮他们完成实验报告。
(1)他们将过量硫粉与少量铁粉混合后隔绝空气加热,制得并分离出固体产物A,请填空。
实验步骤和操作 | 实验现象 | 实验结论或解释 |
①取少量A于试管中,加入足量稀硫酸 | 固体完全溶解,产生有臭鸡蛋气味的气体B | 硫粉与铁粉混合后隔绝空气加热,制得固体产物A是______(填化学式) |
②将B通入足量水中 | 得到无色溶液C | |
③向①的试管中加入KSCN溶液 | 溶液无明显变化 | |
④将浓盐酸滴到KMnO4固体上 | 产生黄绿色气体 | 反应生成氯气 |
⑤将红热的铁丝(少量)伸入上述黄绿色气体中 | 铁丝剧烈燃烧,产生大量棕黄色的烟 | 反应的化学方程式为_____ |
⑥将⑤中所得固体产物溶于水,在所得溶液中滴加KSCN溶液 | 观察到________(填现象) |
(2)综合上述实验现象和结论___(填“能”或“不能”)验证氯元素的非金属性强于硫元素,理由是________。
(3)某同学将上述实验中④所得氯气直接通入无色溶液C中,观察到产生淡黄色固体,反应的化学方程式为_____________,此实验______(填“能”或“不能”)验证氯元素的非金属性强于硫元素。
(4)某同学认为将步骤①中的稀硫酸换成稀盐酸,若同样产生有臭鸡蛋气味的气体B,则可以说明氯元素的非金属性强于硫元素,他的观点______(填“正确”或“错误”),原因是:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com