
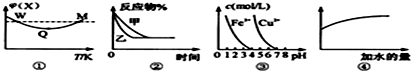
| A、图①表示向恒容密闭容器中充入X和Y发生反应:2X(g)+Y(g)?3Z(g)△H<0,W点X的正反应速率等于M点X的正反应速率 |
| B、图②表示压强对可逆反应A(g)+2B(g)?3C(g)+D(s)的影响,乙的压强比甲的压强小 |
| C、据图③,若要除去CuSO4溶液中的Fe3+,可加入NaOH溶液至PH在4左右 |
| D、常温下,稀释0.1mol/L Na2CO3溶液,图④中的纵坐标可表示溶液中HCO3-的数目 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、SiO2具有较好的导电性,可用于制造半导体材料 |
| B、H2O2是一种绿色氧化剂,可氧化酸性高锰酸钾而产生O2 |
| C、铜的金属活动性比铁弱,可用铜罐代替铁罐贮运浓硝酸 |
| D、Mg在空气中燃烧发出耀眼的白光,可用于制作信号弹 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、该元素属于第六周期 |
| B、该元素位于第ⅢA族 |
| C、该元素为金属元素,性质与82Pb相似 |
| D、该同位素原子含有114个电子,185个中子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | 溴乙烷(Br2) | NaOH溶液 | 分液 |
| C | 乙醇(乙酸) | 饱和Na2CO3溶液 | 分液 |
| D | C2H5OH(H2O) | 新制生石灰 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
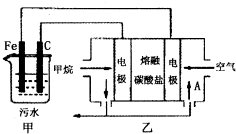 工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )
工业上采用的一种污水处理方法如下:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用.阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.某科研小组用该原理处理污水,设计装置如图所示.下列说法正确的是( )| A、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环的物质A为CO2 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了增加污水的导电能力,应向污水中如入适量的H2SO4溶液 |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2是还原产物 |
| B、KNO3被氧化 |
| C、转移电子的物质的量为5 mol |
| D、被氧化的N原子的物质的量为1 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
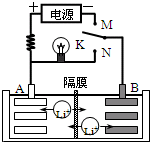 如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:
如图是一种可充电的锂离子电池充、放电的工作示意图.放电时该电池的电极反应式为:A、该电池的反应式为Li1-xMnO2+LixC6
| |||
| B、K与M相接时,A是阳极,发生氧化反应 | |||
| C、K与N相接时,Li+由A极区迁移到B极区 | |||
| D、在整个充电或放电过程中都只存在一种形式的能量转化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下是无色无味气体 |
| B、在通常状况下,密度比空气小 |
| C、能使酸性KMnO4溶液褪色 |
| D、在一定条件下能发生加聚反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| 高温 |
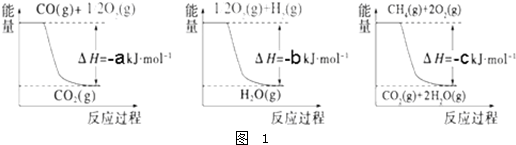
| 高温高压 |
| 催化剂 |
| 容 器 | 甲 | 乙 | 丙 |
| 反应物投入量 | 3mol H2、2mol N2 | 6mol H2、4mol N2 | 2mol NH3 |
| 达到平衡的时间(min) | t | 5 | 8 |
| 平衡时N2的浓度(mol?L-1) | c1 | 3 | |
| N2的体积分数 | ω1 | ω2 | ω3 |
| 混合气体密度(g?L-1) | ρ1 | ρ2 |
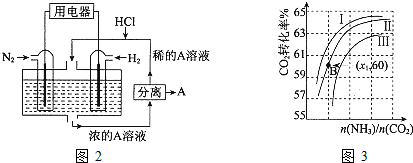
| n(NH3) |
| n(CO2) |
| n(H2O) |
| n(CO2) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com