
【题目】为增强铝的耐腐蚀性,现以铅蓄电池为外电源,以Al作阳极、Pb作阴极,电解稀硫酸,使铝表面的氧化膜增厚.其反应原理如下:电池:Pb(s)+PbO2(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(l);电解池:2Al+3H2O ![]() Al2O3+3H2↑,电解过程中,以下判断正确的是( )
Al2O3+3H2↑,电解过程中,以下判断正确的是( )
电池 | 电解池 | |
A | H+移向Pb电极 | H+移向Pb电极 |
B | 每消耗3molPb | 生成2molAl2O3 |
C | 正极:PbO2+4H++2e﹣=Pb2++2H2O | 阳极:2Al+3H2O﹣6e﹣=Al2O3+6H+ |
D |
|
|
A.A
B.B
C.C
D.D
科目:高中化学 来源: 题型:
【题目】现有含FeCl2杂质的氯化铜晶体(CuCl22H2O),为制取纯净的CuCl22H2O,首先将其制成水溶液,然后按下图所示步骤进行提纯: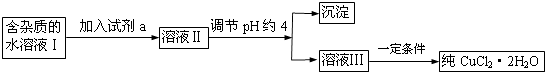
25℃部分阳离子以氢氧化物形式完全沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
开始沉淀pH | 2.7 | 7.6 | 4.7 |
完成沉淀pH | 3.2 | 9.7 | 6.7 |
请回答下列问题:
(1)流程中加入的试剂a最合适的是(填序号)A.酸性高锰酸钾溶液 B.NaClO溶液C.H2O2溶液 D.稀硝酸
加入试剂a的目的是 .
(2)调节pH约4应该加入的物质可以是 .
A.CuO
B.CuCl2
C.Cu(OH)2
D.NaOH
(3)最后能不能直接蒸发结晶得到CuCl22H2O?(填“能”或“不能”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电化学装置的说法正确的是( ) 
A.利用图a装置处理银器表面的黑斑Ag2S,银器表面发生的反应为Ag2S+2e﹣=2Ag+S2﹣
B.图b电解一段时间,铜电极溶解,石墨电极上有亮红色物质析出
C.图c中的X极若为负极,则该装置可实现粗铜的精炼
D.图d中若M是海水,该装置是通过“牺牲阳极的阴极保护法”使铁不被腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、X均为中学化学常见的物质。它们之间存在如下图所示转化关系(图中反应条件略去)填写下列空白:
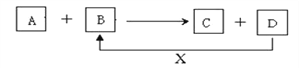
(1)若A为两性氢氧化物, B为NaOH溶液,写出反应A+B→C+D的离子方程式_________,并写出偏铝酸钠溶液中通入过量二氧化碳的离子方程式________________________
(2)若A为金属单质,B、C、D都是化合物,A与B发生的反应常用于刻制印刷电路板,该反应的离子方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄铜矿(主要成分为CuFeS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1) 利用黄铜矿冶炼铜的反应为8CuFeS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
8Cu+4FeO+2Fe2O3+16SO2。已知CuFeS2中Fe的化合价为+2,Cu的化合价为+2,
① 反应中被还原的元素是________(填元素符号),
② 生成1 mol Fe2O3时转移电子的物质的量为________mol。
(2)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为:①用过量稀盐酸浸取炉渣,过滤。②先将滤液氧化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煅烧得Fe2O3。据以上信息回答下列问题:
A.①中过滤的目的是____________________,
B.②中将滤液氧化常常选用H2O2,其反应的离子方程式为____________________。
C.只能选用提供的试剂,设计实验验证炉渣中含有FeO。提供的试剂:稀盐酸、稀硫酸、KSCN溶液、KMnO4溶液、NaOH溶液、碘水,
① 所选试剂为___________________
② 证明炉渣中含有FeO的实验现象为_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向物质的量浓度均为1mol/L的HCl、AlCl3、MgC12、NH4Cl混合溶液中逐滴加入1mol/L的NaOH溶液,得到如图图像。下列有关说法正确的是

A. 沉淀的最大物质的量为2mol
B. c-d段会产生标况下22.4LNH3
C. d-e段发生的反应为Al3++40H-=AlO2-+2H2O
D. 滴加NaOH溶液过程中,微粒反应的先后顺序是H+、Mg2+、NH4+、Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将等体积的SO2和Cl2充分混合,通入加有品红的氯化钡溶液,可观察到的现象是( )
A.溶液快速褪色B.溶液缓慢褪色C.生成白色沉淀D.生成浅黄色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以粗镍(含少量Fe和Cr杂质)为原料制备醋酸镍的工艺流程如下:
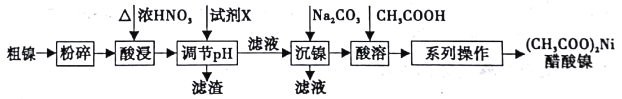
已知:
离子 | Fe3+ | Cr3+ | Ni2+ |
开始沉淀pH | 1.5 | 4.3 | 6.9 |
完全沉淀pH | 2.8 | 5.6 | 8.9 |
回答以下问题:
(1)粗镍原料在酸浸前粉碎的原因是_______________。
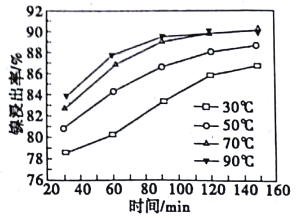
(2)酸浸过程中,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_____℃、_____min。
(3)酸浸中Ni和浓硝酸反应的化学方程式为___________。
(4)加人试剂X为_____(填下列提供试剂的序号),可调节溶液pH至______(填pH范围)。
A.H2SO4 B.Cr2O3 C.NaOH D.Fe2O3
(5)进入“沉镍”步骤的滤液中c(Ni2+)=2.0mol/L,若要处理1L该滤液使Ni2+完全沉淀[c(Ni2+)≤10-5mol/L],则需要加入Na2CO3固体的质量最少为______g。(已知NiCO3的Ksp=9.6×10-6,结果保留小数点后2位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com